
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 元素的性质呈周期性变化的根本原因是核外电子排布呈周期性变化 | |
| C. | 第IA族元素与第VIIA族元素形成的化合物都是离子化合物 | |
| D. | 元素周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
分析 A、同周期元素从左到右非金属性逐渐增强,金属性逐渐减弱;
B、元素性质呈周期性变化的根本原因与电子排布有关;
C、根据原子间形成的化合价类型判断;
D、周期表中的元素大多是自然界存在的,但有些属于人造元素,如106号元素;
解答 解:A、同周期元素从左到右非金属性逐渐增强,金属性逐渐减弱,原子半径逐渐减小,则同周期元素的原子半径越小越难失去电子,故A错误;
B、元素性质呈周期性变化的根本原因与电子排布有关,则素性质呈周期性变化的根本原因是核外电子排布呈周期性变化引起的,故B正确;
C、IA族元素中的H元素与VIIA元素形成的化合物都为共价化合物,故C错误;
D、周期表中的元素大多是自然界存在的,但有些属于人造元素,都是放射性元素,包括Tc、Pm、At、Np、Pu、Am、Cm、Bk、Cf、Es、Fm、Md、No、Lr、Rf、Db、Es、Bh、Hs、Mt和110、111、112号元素,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,明确位置与性质的关系、周期表的结构是解答的关键,题目难度不大.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:解答题
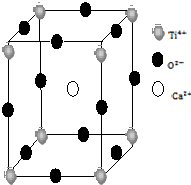 金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.
金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | N2的电子式: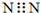 | ||
| C. | 硫离子结构示意图: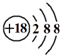 | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
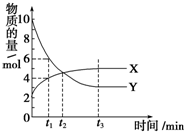 一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为3X(g)?7Y(g) | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等 | |
| D. | 0到t1时间段内,Y的平均反应速率为4/t1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C60与14C60互为同位素 | |
| B. | 14C转变为12C的过程属于化学变化 | |
| C. | 12C与14C的原子中含有的中子数之比为3:4 | |
| D. | 金刚石与C60都属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:Y>X>W>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 电负性:Y>X>W>Z | D. | 简单气态氢化物的沸点:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ⑨ |
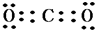 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程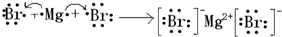
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
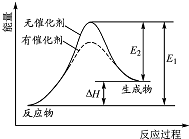 某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( )| A. | 催化剂能改变该反应的焓变 | B. | 催化剂能降低该反应的活化能 | ||
| C. | 该反应为放热反应 | D. | E1 越大,表明该反应越容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com