
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2 , 加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
【答案】D
【解析】A.可逆反应2NO2 ![]() N2O4 , 加压条件下,体积减小,混合气体各组分的浓度增大,故颜色变深,但增大压强,平衡向气体体积减小的方向移动,即正向移动,颜色逐渐变浅,所以可以用平衡移动原理解释,A项不符合题意;
N2O4 , 加压条件下,体积减小,混合气体各组分的浓度增大,故颜色变深,但增大压强,平衡向气体体积减小的方向移动,即正向移动,颜色逐渐变浅,所以可以用平衡移动原理解释,A项不符合题意;
B.2SO2+O2(g) ![]() 2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3 , 能用平衡移动原理解释,B项不符合题意;
2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3 , 能用平衡移动原理解释,B项不符合题意;
C.向硫氰化铁溶液中加入硫氰化钾固体时,硫氰根离子浓度增大,平衡向正反应方向移动,则硫氰化铁浓度增大,溶液的颜色变深,可用平衡移动原理解释,C项不符合题意;
D.H2+I2(g) ![]() 2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释,D项符合题意。勒夏特列原理(又称平衡移动原理)主要内容为:在一个已经达到平衡的反应中,如果改变ing想平衡的条件之一(如温度、压强,以及参加化学反应的物质的浓度),平衡将向着减弱这种改变的方向移动。
2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释,D项符合题意。勒夏特列原理(又称平衡移动原理)主要内容为:在一个已经达到平衡的反应中,如果改变ing想平衡的条件之一(如温度、压强,以及参加化学反应的物质的浓度),平衡将向着减弱这种改变的方向移动。
A、2NO2 N2O4,加压使浓度瞬间增大,颜色加深,据移动原理,平衡向压强减小方向进行 , 颜色变浅
B、2SO2+O2(g) 2SO3(g),增大压强,平衡向压强减小方向进行,有利于合成SO3
C、Fe3++3SCN-=Fe(SCN)3加入固体KSCN,使SCN-浓度增大,平衡向减小SCN-浓度的方向移动
D、H2+I2(g) 2HI(g),反应前后气体压强不变,所以加压,平衡不移动。但加压造成各物质浓度增大,气体颜色加深。


科目:高中化学 来源: 题型:
【题目】下列描述中不正确的是 ( )
A. CS2为直线形的非极性分子
B. ClO3-的立体构型为平面三角形
C. SF6中有6对完全相同的成键电子对
D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据键能数据(H—Cl 431 kJ/mol,H—I 297 kJ/mol),可得出的结论是 ( )
A. 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸
B. HI比HCl熔、沸点高
C. HI比HCl稳定
D. 拆开等物质的量的HI和HCl,HI消耗的能量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中第_____周期,_____族;
(2)比较X与Y的气态氢化物的稳定性:_____(写化学式);
(3)XW2的电子式为_____;
(4)比较X、Y、Z、W四种原子半径由大到小关系:_____;
(5)X和W形成的化合物属于_____ (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明CH4分子的5个原子不在同一平面而为正四面体构型的是( )
A.两个键之间夹角为109°28′ B.C—H键为极性共价键
C.4个C—H键的键能、键长相同D.碳的价层电子都形成共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A.HCO3- + H2O ![]() H3O+ + CO32-
H3O+ + CO32-
B.Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C.HS- + H2O ![]() H2S + OH-
H2S + OH-
D.NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2为红棕色气体,可在火箭燃料中作氧化剂。回答下列问题:
(1)火箭用N2H4和NO2作燃料,产物绿色无污染,该反应的化学方程式为____________。
(2)为探究NO2和铁粉反应的产物,某小组按下图所示装置进行实验。
已知:①二者反应可能的还原产物为N2或NO
②沸点:NO2(21℃),NO(-152℃)
③酸性KMnO4溶液能氧化NO生成NO3-
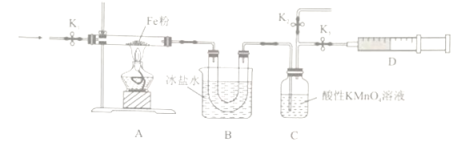
①按上图所示组装完实验仪器后,下一步操作为______________________________。
②实验前需利用气体X将装置的空气排净,气体X可以为_______(填标号)。
A.Ar B.H2 C.CO D.NO2
③排净空气后,后续实验的最佳操作顺序是___c、b(填标号)。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开K1和K2,关闭K3,缓缓通入气体X
d.打开K1和K3,关闭K2,缓缓通入NO2 e.关闭K1,停止通入NO2
④装置B的作用是__________________________________。
(3)分析NO2和铁粉反应的产物
①实验过程中A、C装置的物质均无明显颜色变化,D收集到无色气体。由此可推知气体产物为____________________________。
②取少量固体产物于试管,先加入盐酸充分溶解,再加入KSCN溶液,溶液若无血红色,则产物不含三价铁。该方案是否可行并说明理由:_______________________________。
③实验得到的相关数据如下表:
玻璃管质量/g | Fe质量/g | 反应后(玻璃管+固体)/g |
m | 1.12 | m+1.52 |
综合实验现象和计算可知,固体生成物一定有______(填“FeO”Fe2O3”或“Fe3O4”);反应的方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是

A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C--C键间的夹角是( )
A.6个120° B.5个108° C.4个109°28′ D.6个109°28′
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com