
����Ŀ�����û�ѧ��Ӧԭ���о�������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���塣
(1)��������������2SO2(g)��O2(g)![]() 2SO3(g)��ƽ������ϵ��SO3�İٷֺ������¶ȵĹ���ͼ��ʾ��������ͼ�ش��������⣺
2SO3(g)��ƽ������ϵ��SO3�İٷֺ������¶ȵĹ���ͼ��ʾ��������ͼ�ش��������⣺

��2SO2(g)��O2(g)![]() 2SO3(g)Ϊ__________��Ӧ������������������������
2SO3(g)Ϊ__________��Ӧ������������������������
��һ�������£���SO2��O2�������Ϊ2�U1����һ���������ܱ������з�����Ӧ����˵���÷�Ӧ�Ѵﵽƽ�����________(��ѡ����ĸ)��
a����ϵ���ܶȲ������仯
b��SO2��SO3������ȱ��ֲ���
c����ϵ����Ԫ�ص������������ٱ仯
d����λʱ����ת��4 mol���ӣ�ͬʱ����2 mol SO3
e�������ڵ���������������ٱ仯
��V2O5����Ϊ2SO2(g)��O2(g)![]() 2SO3(g)�Ĵ�������ѭ����������Ϊ��V2O5����SO2ʱ����������ԭΪ�ļ۷�������ļ۷��������ٱ���������ΪV2O5��дҲ�ô�ѭ�������Ļ�ѧ����ʽ__________��________��
2SO3(g)�Ĵ�������ѭ����������Ϊ��V2O5����SO2ʱ����������ԭΪ�ļ۷�������ļ۷��������ٱ���������ΪV2O5��дҲ�ô�ѭ�������Ļ�ѧ����ʽ__________��________��
(2)һ�������£��ϳɰ���ӦΪ��N2(g)��3H2(g)![]() 2NH3(g)��H<0��ͼ1��ʾ��2 L���ܱ������з�ӦʱN2�����ʵ�����ʱ��ı仯���ߡ�ͼ2��ʾ�������������������£��ı���ʼ�����������ʵ����Դ˷�Ӧƽ���Ӱ�졣
2NH3(g)��H<0��ͼ1��ʾ��2 L���ܱ������з�ӦʱN2�����ʵ�����ʱ��ı仯���ߡ�ͼ2��ʾ�������������������£��ı���ʼ�����������ʵ����Դ˷�Ӧƽ���Ӱ�졣
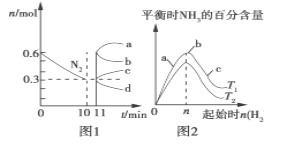
����ͼ1��Ϣ����11 min�������������䣬ѹ�����������Ϊ1 L����n(N2)�ı仯����Ϊ________(����a����b����c������d������ͬ)�����ӵ��������ʵ�������n(N2)�ı仯����Ϊ________��
����ͼ2��Ϣ��a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ���________�㣬T2____T1(����>������������<��)��
���𰸡�< be SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5 d b c >
��������
��1���ٸ���ͼ�������¶ȵ����ߣ�SO3�İٷֺ������ͣ��������¶ȣ�ƽ�����淴Ӧ������У�������������ԭ��������ӦΪ���ȷ�Ӧ������H<0��
��a����ֶ������壬�����������䣬����Ϊ����״̬������������䣬�����ܶȶ��壬�ܶ��κ�ʱ�̱��ֲ��䣬���ܶȲ��䣬����˵����Ӧ�ﵽƽ�⣬��a���������⣻
b��SO2��SO3������ȱ��ֲ��䣬�ó�SO2��SO3�����ʵ������ֲ��䣬���ﵽƽ�⣬��b�������⣻
c������ԭ���غ㣬��ϵ����Ԫ�ص���������ʼ�ձ��ֲ��䣬����˵����Ӧ�ﵽƽ�⣬��c���������⣻
d��ת��4mol���ӣ������Ļ�����2molSO3������˵����Ӧ�ﵽƽ�⣬��d���������⣻
e��������Ӧ������У��������ʵ�����С������������С���������������䣬˵����Ӧ�ﵽƽ�⣬��e�������⣻
�۸������⣬V2O5����SO2��SO3����������ԭ��ΪVO2����Ӧ����ʽΪV2O5��SO2=SO3��2VO2��VO2������������V2O5����Ӧ����ʽΪ4VO2��O2=2V2O5��
��2����ѹ���������ı�˲��N2�����ʵ������䣬ѹ��������������൱������ѹǿ��������������ԭ��������ѹǿ���˷�Ӧ������Ӧ������У�N2�����ʵ�����С����dΪn(N2)�仯���ߣ�����N2�����ʵ���,N2�����ʵ������ӣ�ƽ��������Ӧ������У�N2���ʵ������٣���b����n(N2)�ı仯���ߣ�
������H2����ʼ����N2��ת��������N2��ת������ߵĵ���c��������ʼ����ͬʱ���¶�T1ƽ������ĺ������ߣ��÷�ӦΪ���ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ������T1<T2��


 ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д� �γ̴����Ծ�����100��ϵ�д�
�γ̴����Ծ�����100��ϵ�д� �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ܷ���ˮ�ⷴӦ���ǣ� ��
A.�Ҵ�B.��ά��C.��ѿ��D.��֬���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ�л���֮����ת�����Դ���̫���ܣ���ԭ����Ƭ��ϩ(NBD)����̫������ת����Ϊ�Ļ���(Q)����֪�� ��C7H8(l)(NBD)��9O2(g)=7CO2(g)��4H2O(l)����H1����C7H8(l)(Q)��9O2(g)=7CO2(g)��4H2O(l)����H2����
![]()
![]() ����H��+88.62 kJ��mol��1��������������ȷ����(����)
����H��+88.62 kJ��mol��1��������������ȷ����(����)
A. ��H1>��H2 B. NBD��������Q��������
C. NBD��Q�ȶ� D. NBDת��ΪQ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ʊ�����ˮ��ͨ������![]() ���壬����ʹ��Һ
���壬����ʹ��Һ![]() ����
����![]()
A. Ư������ǿ B. ��������ǿ C. ������ǿ D. ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ԥ�ԣ�ȼ�ϵ�ؽ���21���ͻ�õ��ܵ���Ҫ;���������꿪���ļ״�ȼ�ϵ���Dz��ò����缫����������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ����ʾ��ͼ���£�
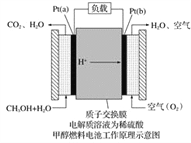
��ش��������⣺
��1��Pt(a)�缫�ǵ�ص�________�����缫��ӦʽΪ__________________��Pt(b)�缫����________(���������ԭ��)��Ӧ���缫��ӦʽΪ___________��
��2����ص��ܷ�Ӧ����ʽΪ____________________��
��3������õ�ع���ʱ��·��ͨ��2 mol���ӣ������ĵ�CH3OH��______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������������ȼ�գ�����ΪPCl3��PCl5
��2P+3Cl2=2 PCl3 ��2P+5Cl2=2 PCl5
��1������1mol�װ���ʽ��ȫ��Ӧ���õ�����________�ˣ�����Щ�����к��й��ۼ�����ĿΪ________��
��2������12.4g����0.90mol����ͬʱ�����١�����ʽ��Ӧ����Ӧ��������������ʣ�ࡣ���������PCl3��PCl5�����ʵ�����_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊԭ�ϣ�ͨ��̼�Ȼ�ԭ���ɺϳɵ�������AlN����ͨ����ⷨ����ȡ���������ʱ����������CO2����ͨ��������̼�״��������á���ش�
��1����֪��2Al2O3��s����4Al��g��+3O2��g����H1��+3 351kJmol��1
2C��s��+O2��g����2CO��g����H2����221kJmol��1
2Al��g��+N2��g����2AlN��s����H3����318kJmol��1
��̼�Ȼ�ԭAl2O3�ϳɵ����������Ȼ�ѧ����ʽΪ_____��
��2���ڳ�ѹ��Ru/TiO2���£�CO2��H2������壨�����1��4�������ʵ���a mol�����з�Ӧ�����CO2��ת���ʡ�CH4��CO��ѡ�������¶ȵı仯����ֱ���ͼ1��ͼ2��ʾ��ѡ���ԣ�ת����CO2������CH4��CO�İٷֱȣ���
��Ӧ��CO2��g��+4H2��g��CH4��g��+2H2O��g����H1
��Ӧ��CO2��g��+H2��g��CO��g��+H2O��g����H2
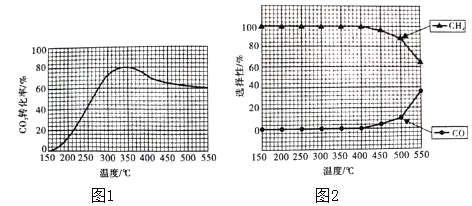
������˵������ȷ����_____������ţ���
A����H1����
B���¶ȿ�Ӱ������ѡ����
C��CO2��ƽ��ת�������¶���������������
D�������������佫CO2��H2�ij�ʼ����ȸı�Ϊ1��3�������CO2��ƽ��ת����
��350��ʱ����Ӧ����t1ʱ�̴ﵽƽ�⣬ƽ��ʱ���������ΪVL������¶��·�Ӧ���ƽ�ⳣ��Ϊ____����a��V��ʾ����
��350��ʱ��CH4�����ʵ�����ʱ��ı仯������ͼ��ʾ������400��ʱ��0��t1ʱ����ڣ�CH4�����ʵ�����ʱ��ı仯���ߡ�____
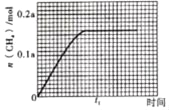
��3��CO2��H2��һ�������·�����Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g����ƽ�ⳣ��K��![]() �����ݻ�Ϊ2L���ܱ������У�����2 mol CO2��6 mol H2�����º���ʱ�ﵽƽ�⡣��ͬ�����£�����һ��2 L���ܱ������г���a mol CO2��b mol H2��c mol CH3OH��d mol H2O��g����Ҫʹ�������ﵽ��ͬ��ƽ��״̬������ʼʱ��Ӧ������У���d��ȡֵ��ΧΪ_____��
�����ݻ�Ϊ2L���ܱ������У�����2 mol CO2��6 mol H2�����º���ʱ�ﵽƽ�⡣��ͬ�����£�����һ��2 L���ܱ������г���a mol CO2��b mol H2��c mol CH3OH��d mol H2O��g����Ҫʹ�������ﵽ��ͬ��ƽ��״̬������ʼʱ��Ӧ������У���d��ȡֵ��ΧΪ_____��
��4���о�������CO2������������Һ�������Ե缫������ɼ״��������ɼ״��ĵ缫��ӦʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£���20 mL NaOH��Һ����μ���0.1 mol��L-1�Ĵ�����Һ,�ζ���������ͼ��ʾ�������ж���,��ȷ����
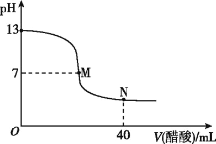
A. ��M��,����ǡ����ȫ��Ӧ
B. �ζ�ǰ,����c(H+)���ڼ���c(OH-)
C. NaOH��Һ�����ʵ���Ũ��Ϊ0.1 mol��L-1
D. ��N��,c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �����ʵ���Ũ����ȵ�������Һ����(NH4)2SO4 �� (NH4)2Fe(SO4)2 ��(NH4)2CO3�����ʵ����ʵ���Ũ���ɴ�С��˳��Ϊ
�����ʵ���Ũ����ȵ�������Һ����(NH4)2SO4 �� (NH4)2Fe(SO4)2 ��(NH4)2CO3�����ʵ����ʵ���Ũ���ɴ�С��˳��Ϊ
A. �� > �� > �� B. �� > �� > ��
C. �� > �� > �� D. �� > �� > ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com