
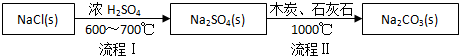
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
���� ��·������������ʳ�ξ����Ũ�����ڸ����·�Ӧ���������ƺ��Ȼ��⣬������C��ʯ��ʯ�������Ƹ��¼�������̼���ƣ�
��1�����̢����������ƣ���һ�ֲ�������������غ��ԭ���غ��жϣ�������ʯ��ʯ�������ֽⷴӦ�Ļ�ѧ����ʽΪNa2S+CaCO3$\frac{\underline{\;����\;}}{\;}$Na2CO3+CaS����������ʽ��Ӽ��ɵõ��ܷ�Ӧʽ��
������ά�ð������̼���ƣ���Ӧԭ��Ϊ���ð������͵�NaCl��CO2��Ӧ�õ�NaHCO3����̼�����Ʒֽ⼴�ɵõ�����̼���ƣ�
��2������ά�ð������̼���ƣ�ԭ��CO2��Դ��ʯ��ʯ��CaCO3���ķֽ⣬����ʳ�Ρ�������ˮ����̼�����Ʒֽ�����CO2�ʹ���Ȼ�茶���ֽ����ɰ�����ѭ�������Dzμӷ�Ӧ�����������ɵ����ʣ�
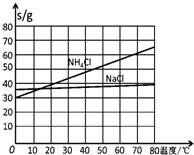
��3����ͬ�¶��£�̼�����Ƶ��ܽ������С��̼���ƣ�
��°��о��������ƼΪ�ڱ��͵��Ȼ�����Һ��ֱ��ͨ�백����CO2���õ��Ȼ�狀�̼�����ƾ��壬������̼�����Ƶķֽ��Ƶô��
��4�������Ƽ�ᾧ��̼̼�����ƺ����Һ����Ҫ�����Ȼ�泥������Ȼ��Ʋ�ͨNH3���ɴٽ�NH4Cl��s��?NH4+��aq��+Cl-��aq���ܽ�ƽ�������ƶ������������Ȼ�泥���ѡ���ڵ����½��У��Է�ֹ�����������壮
��� �⣺��·������������ʳ�ξ����Ũ�����ڸ����·�Ӧ���������ƺ��Ȼ��⣬������C��ʯ��ʯ�������Ƹ��¼�������̼���ƣ�
��1�����̢����ø߷е����ƻӷ�����ԭ�����Ȼ�����Ũ�����ϼ��ȣ����������ƺ��Ȼ��⣻a��Na2SO4+4C$\frac{\underline{\;1000��\;}}{\;}$Na2S+4CO����b��Na2S��ʯ��ʯ�������ֽⷴӦ�Ļ�ѧ����ʽΪNa2S+CaCO3$\frac{\underline{\;1000��\;}}{\;}$Na2CO3+CaS����������ʽ��Ӽ��ɵõ��ܷ�Ӧʽ Na2SO4+4C+CaCO3 $\frac{\underline{\;1000��\;}}{\;}$Na2CO3+CaS+4CO����
�ʴ�Ϊ��HCl�� Na2SO4+4C+CaCO3 $\frac{\underline{\;1000��\;}}{\;}$Na2CO3+CaS+4CO����
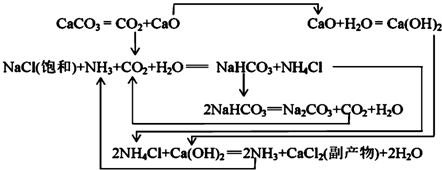
������ά�ð������̼���ƣ���Ӧԭ��Ϊ���ð������͵�NaCl��CO2��Ӧ�õ�NaHCO3����̼�����Ʒֽ⼴�ɵõ�����̼���ƣ�
��2������ά��ʳ�Ρ�ˮ��������CO2��Ӧ�Ʊ�̼�����ƣ����п�����ʯ��ʯ��CaCO3���ֽ�õ�CO2��̼�����Ʒֽⴿ�ͬʱ�õ�CO2�����⸱��Ʒ�Ȼ�茶���ֽ������ɰ����������������ѭ�����ã�����ת����·ʯ��ʯ��CaCO3���ֽ�õ������ƺ�CO2�����ɵ��Ȼ�刺������������Ʒ�Ӧ��CaO��NH4ClҲ��ѭ��ʹ�ã�
�ʴ�Ϊ��ʳ�Ρ�ˮ��������CO2��CaO��CO2��NH4Cl��NH3��
��3������ͬ�¶��£�̼�����Ƶ��ܽ������С��̼���ƣ���NaCl��ҺͨNH3��CO2ֻ������NaHCO3��ͬʱ��Ӧ����ˮ��������������̼�����ƣ�
�ʴ�Ϊ����Ӧ��ϵ��NaHCO3�ܽ����С����Ӧ����ˮ��NaHCO3��Է����������
��°��о��������ƼΪ�ڱ��͵��Ȼ�����Һ��ֱ��ͨ�백����CO2���õ��Ȼ�狀�̼�����ƾ��壬������̼�����Ƶķֽ��Ƶô��
��4���ں����Ȼ�淋���Һ�У������Ȼ��Ʋ�ͨNH3���������Һ��Cl-��NH4+��Ũ�ȣ��ٽ�NH4Cl��s��?NH4+��aq��+Cl-��aq���ܽ�ƽ�������ƶ������������Ȼ�泥���NH4Cl�������ܽ�ȱȽ�С�����¸���NH4Cl�������������Է�ֹ�����������壬
�ʴ�Ϊ��0��10�棻NH4Cl��
���� ����̽�����ֲ�ͬ����Ʊ�����̼���Ƶ�ʵ��ԭ�����漰��Ӧԭ�����ܽ�ȼ������ķ���������������Կ��飬��Ŀ�Ѷ��еȣ��ѵ�Ϊ��Ӧԭ���ķ�����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢ڢ� | C�� | �ڢۢ� | D�� | ���ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{1}{\sqrt{a}}$ | B�� | $\sqrt{a}$ | C�� | $\frac{1}{2}$a | D�� | $\frac{1}{\frac{1}{2}a}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
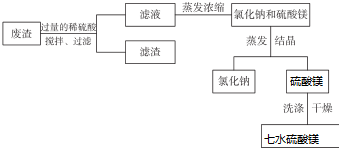
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
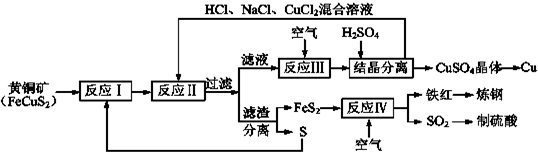
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com