
| A. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 水溶液中Fe2+、H+、SO${\;}_{3}^{2-}$、ClO-不能大量共存 |
分析 A.酸性条件下,NO3-能把Fe2+氧化为Fe3+;
B.浓氨水中滴加FeCl3饱和溶液得到Fe(OH)3沉淀;
C.FeI2与足量氯气反应生成FeCl3和I2;
D.ClO-能氧化还原性离子.
解答 解:A.将Fe(NO)2样品溶于稀H2SO4后,酸性条件下,NO3-能把Fe2+氧化为Fe3+,滴加KSCN溶液变红,不能说明Fe(NO3)2晶体已经变质,故A错误;
B.浓氨水中滴加FeCl3饱和溶液得到Fe(OH)3沉淀,向沸水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体,故B错误;
C.FeI2与足量氯气反应生成FeCl3和I2,1 mol FeI2与足量氯气反应时转移的电子数为3NA,故C错误;
D.ClO-能氧化还原性离子,Fe2+、SO${\;}_{3}^{2-}$具有还原性,所以水溶液中Fe2+、H+、SO${\;}_{3}^{2-}$、ClO-不能大量共存,故D正确.
故选D.
点评 本题考查了铁离子及亚铁离子的检验、铁及其化合物的性质,题目难度不大,把握物质的性质及物质之间的转化是解题的关键.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 等于10mL | B. | 小于10mL | C. | 大于10mL | D. | 等于5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | 中子数为1的氢原子:${\;}_{1}^{1}$H | ||
| C. | 甲基的电子式: | D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其合成路线如图所示:
,其合成路线如图所示:
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

实验次数[来源:Zxxk.Com] 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
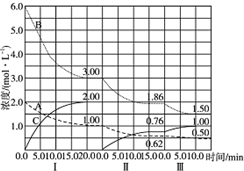 反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:
反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2min内A的化学反应速率为0.1 mol/(L•min) | |
| B. | 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动 | |
| C. | 在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大 | |
| D. | T1和T2时的平衡常数大小关系:前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | X | Y | Z |
| ① | N2 | Mg | CO2 |
| ② | FeCl3溶液 | Cu | 浓硝酸 |
| ③ | 氨水 | Al(OH)3 | 稀硫酸 |
| ④ | KOH溶液 | SiO2 | 盐酸 |
| A. | ①② | B. | ①④ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com