
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | 0.5H2SO4(aq)+0.5Ba(OH)2(aq)═0.5BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
分析 A、燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量;
B、中和热是强酸和强碱的稀溶液完全反应生成1mol水时放出的热量,依据概念对选项分析判断;
C、根据反应热和化学方程式系数的关系来回答;
D、根据盖斯定律计算反应的焓变.
解答 解:A.燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量,H2的燃烧热为$\frac{1}{2}$×571.6 KJ/mol,故A错误;
B、反应过程中除了氢离子和氢氧根离子反应放热,硫酸钡沉淀的生成也伴随有沉淀热的变化,故B错误;
C、2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,1g氢气燃烧放热$\frac{1}{4}$×571.6kJ=142.9kJ,2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1,1g甲醇燃烧放热$\frac{1}{64}$×1452kJ=22.7kJ,同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多,故C正确;
D、①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,②2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1,根据盖斯定律$\frac{3}{2}$×①-$\frac{1}{2}$×②得到:3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1,故D正确.
故选CD.
点评 本题考查反应热与焓变,侧重于热化学方程式的理解,注意把握热化学方程式的意义以及燃烧热的定义,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
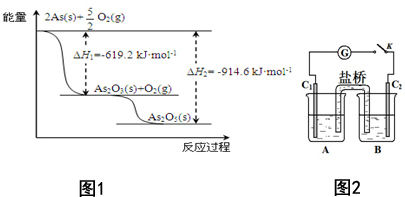 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1 mol/L氯化钠溶液 | B. | 75mL 2 mol/L氯化镁溶液 | ||
| C. | 50mL 3 mol/L氯化钾溶液 | D. | 50mL 1 mol/L氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片加入FeCl3溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| B. | 盐酸中加入Ca CO3:CO32-+2H+═H2O+CO2↑ | |
| C. | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g | B. | 2.7 g | C. | 4.05g | D. | 5.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-、MnO4- | |
| B. | 肯定存在的离子是SO32-、Br-;Na+、K+离子至少有一种存在 | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断有影响. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
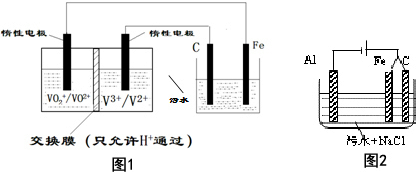
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| D. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com