
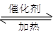 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。科目:高中化学 来源:不详 题型:单选题
| A.由图1可知合成氨反应为自发反应,加入适当的催化剂,E和△H都减小 |
| B.图2表示向含有H+、Mg2+、Al3+、NH4+中加入NaOH溶液与产生沉淀质量的变化关系 |
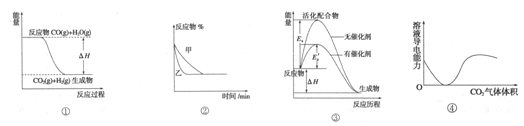
| C.图3表示合成氨反应在其他条件不变的情况下,改变起始物n(H2)对此反应平衡的影响。可知反应物N2的转化率最高的是b点;T1>T2,K2> K1(T1和T2表示温度,K1、K2表示对应温度下平衡常数) |
| D.图4表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
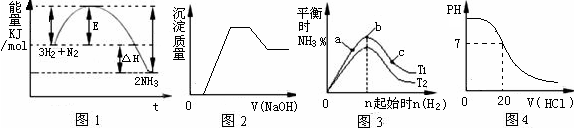
| A.肼分子中所有原子都达到8电子的稳定结构 |
| B.肼-氧气燃料电池,负极的电极反应为:O2 +2H2O+4e-=4OH- |
| C.肼燃烧的热化学方程式为:N2H4(g)+O2(g) = N2(g) +2H2O(g);△H=-642 kJ·mol-1 |
| D.肼沸点高达l13℃,可推测肼分子间可形成氢键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
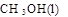 +
+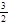
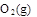 =
= 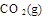 + 2
+ 2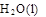 △H = -725.5 kJ·mol-1
△H = -725.5 kJ·mol-1
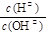 = 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为 ;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1 V2(填“>”、“<”或“=”)。
= 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为 ;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1 V2(填“>”、“<”或“=”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)
CH3OH(g) CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。 中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
 ②300℃时反应开始10分钟内,H2的平均反应速率为__________。
②300℃时反应开始10分钟内,H2的平均反应速率为__________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) ΔH<0,(Ⅱ)3A(g)
2C(g) ΔH<0,(Ⅱ)3A(g)  D(g)+E(g) ΔH>0,达到平衡后,改变下列条件均能使反应(Ⅰ)(Ⅱ)中A的转化率增大的是
D(g)+E(g) ΔH>0,达到平衡后,改变下列条件均能使反应(Ⅰ)(Ⅱ)中A的转化率增大的是| A.仅① | B.①③ | C.①②③ | D.都不能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.图①表示可逆反应CO(g)+H20(g) 5C02 (g)+H2 (g)△H>0 5C02 (g)+H2 (g)△H>0 |
B.图②表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)影响,乙的压强大 3C(g)+D(s)影响,乙的压强大 |
| C.图③表示有无催化剂化学反应中能量变化 |
| D.图④表示C02通人饱和碳酸钠溶液中,溶液导电性变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
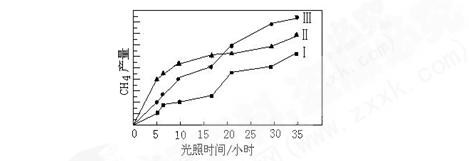
 CO(g)+3H2(g),该反应的△H="+206" kJ?mol-1
CO(g)+3H2(g),该反应的△H="+206" kJ?mol-1 果保留两位有效数字)。
果保留两位有效数字)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.d、e、f | B.b、d、e、f | C.b、d、e | D.b、c、e、f |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com