
 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液, 溶液呈橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液, 溶液呈橙色。科目:高中化学 来源:不详 题型:填空题
 N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:
N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示: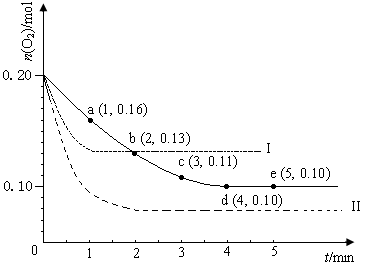
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)△H<0。
2NH3(g)△H<0。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: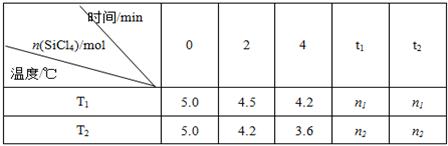
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增大催化剂的表面积,能增大氮气的转化率 |
| B.增大催化剂的表面积,能同时、同程度增大合成氨的正、逆反应速率 |
| C.工业合成氨采用高压,且压强越高越有利于提高经济效益 |
| D.当断裂3mol H-H键的同时断裂2mol N-H键时,达到了化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是
2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是| A.单位时间里生成n mol S2Cl2的同时也生成n mol SCl2 |
| B.达到平衡时,若升高温度,压强不变,氯气转化率增大 |
| C.达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2 |
| D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com