
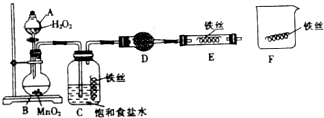
分析 (1)仪器A是分液漏斗,B中发生的反应是过氧化氢在二氧化锰催化下发生分解生成氧气和水;
(2)饱和食盐水呈中性,因此发生的是吸氧腐蚀;
(3)D中为干燥水蒸气的固体干燥剂;
(4)由实验可知,该类铁生锈的条件是铁处于潮湿的环境和较高浓度的氧气中.
解答 解:(1)仪器A是分液漏斗,B中发生的反应是过氧化氢在二氧化锰催化下发生分解生成氧气和水,化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O,
故答案为:分液漏斗;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O;
(2)饱和食盐水呈中性,因此发生的是吸氧腐蚀,
故答案为:吸氧腐蚀;
(3)D中为干燥水蒸气的固体干燥剂,可以选用碱石灰或氯化钙,目的是干燥氧气,
故答案为:碱石灰或氯化钙;干燥氧气;
(4)①饱和食盐水中的铁丝表面颜色变得灰暗,发生锈蚀,环境潮湿,氧气浓度高,
②硬质玻璃管E中的干燥铁丝表面依然光亮,没有发生锈蚀,没有水蒸气,
③F烧杯中潮湿的铁丝表面依然光亮,氧气浓度低,
由实验可知,该类铁生锈的条件是铁处于潮湿的环境和较高浓度的氧气中,
故答案为:跟水和较高浓度的氧气接触.
点评 本题考查了铁生锈的条件,难度不大,通过实验装置、步骤和现象总结出实验原理是关键,注意实验解题能力的培养.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:解答题
 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
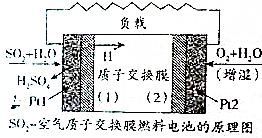 二氧化硫、空气质子交换膜电池将化学能默认变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示,下列说法错误的是( )
二氧化硫、空气质子交换膜电池将化学能默认变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示,下列说法错误的是( )| A. | Pt1电极附近发生的反应为SO2+2H2O-2e-═SO42-+4H+ | |
| B. | Pt2电极附近发生的反应为O2+4e-═2O2- | |
| C. | 该电池放电时电子从Pt1电极经过外电路流到Pt2电极 | |
| D. | 相同条件下,放电过程中消耗的SO2和O2的体积之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:
如图所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
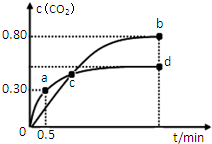 利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝在空气中能生成一层致密的氧化物保护膜 | |
| B. | 铜的化学性质不活泼,在潮湿的空气中也不生锈 | |
| C. | 钛具有耐腐蚀性,可用来制造海轮的外壳 | |
| D. | 镀锌的“白铁皮”不易生锈,说明锌没有铁活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 煤炭、石油、沼气 | B. | 风能、太阳能、沼气 | ||
| C. | 地热能、海洋能、核能 | D. | 生物质能、天然气、水能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com