
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。利用如图所示装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是( )
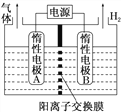
A. B极区电解液为LiCl溶液
B. 阳极电极反应式为2Cl--2e-===Cl2↑
C. 电解过程中Li+向A电极迁移
D. A极区产生0.1mol气体,则溶液中有0.4molLi+移向B电极
科目:高中化学 来源: 题型:
【题目】无色透明的某强酸性溶液中能大量共存的离子组是
A.Na+、Mg2+、Cl-、OH-B.Ca2+、K+、Cl-、NO3-
C.Cu2+、K+、SO42-、NO3-D.Na+、HCO3-、OH-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. NH3·H2O的电离平衡常数随着温度升高而减小
B. 在0.10 mol·L-1 CH3COOH溶液中,加入少量CH3COONa晶体后,溶液的pH减小
C. 强酸、强碱和大部分盐类都是强电解质,其他化合物都是弱电解质
D. 相同温度下,醋酸溶液的导电能力可能比稀硫酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A.Mg2+、Na+、SO42、ClB.Na+、Cu2+、SO42、NO3-
C.Na+、K+、OH、ClD.Ba2+、CO32、NO3-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.金刚石、白磷、水银都属于单质
B.重过磷酸钙、盐酸、水煤气都属于纯净物
C.氯化铵、碳酸、碳酸钙都属于强电解质
D.木炭、硫、磷在氧气中燃烧都发出白光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400 ℃时,某密闭容器中有X、Y、Z三种气体,从反应开始到达到平衡时各物质浓度的变化如图甲所示(假定反应向正反应方向进行)。图乙为相应时刻仅改变反应体系中某一条件后正、逆反应速率随时间变化的情况。
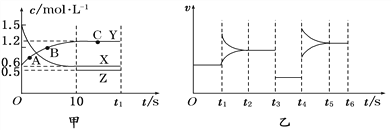
(1)反应从开始至平衡时v(X)=________________;A、B、C三点的逆反应速率由大到小的顺序为_______________________________________________。
(2)若t3 s时改变的条件是降低压强,则Z物质的起始浓度是________;400 ℃时该反应的平衡常数为________。
(3)t4 s时改变的条件是________,若该反应具有自发性,则此时平衡向________________(填“正反应方向”或“逆反应方向”)移动。
(4)在图乙中绘制出t6 s时向容器中加入一定量X后建立新平衡的过程中(压强保持不变)正、逆反应速率的变化曲线并注明速率类型。____________________
(5)研究表明,该反应经过如下几个阶段:
3X(g)![]() 2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)
2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)![]() Z(g) ΔH3
Z(g) ΔH3
试写出X、Y、Z间反应的热化学方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com