
【题目】已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12,如图是向10mL AgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象。根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为1mol·L-1
B. 图中x点满足c(Ag+)·c(Cl-)= Ks p( AgCl)
C. 相同实验条件下,把0.1mol·L-1的NaCl换成0.1mol·L-1NaI则图象在终点x的纵坐标小于6
D. 相同实验条件下,若改为0.2mol·L-1 NaCl溶液时,x点的横坐标小于100
【答案】C
【解析】
A.开始时pAg=0,则c(Ag+) =1mol/L,选项A正确;
B.pAg=6,c(Ag+)=1×10—6,因c(Cl-)= c(Ag+)=10-6,故KspAgCl= c(Ag+)·c(Cl-),选项B正确;
C、与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol/L的NaCl换成0.1mol/LNaI,则溶液中c(Ag+)更小,则pAg更大,则图象在终点x的纵坐标大于6,选项C不正确;
D、x点c(Ag+)=10-6 mol/L,一般认为溶液中离子浓度小于10-5 mol/L,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol/L=0.01mol,若改为0.2mol·L-1 NaCl溶液时,V(NaCl)=![]() =0.05L=50mL,即x点的横坐标小于100,选项D正确;
=0.05L=50mL,即x点的横坐标小于100,选项D正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知反应A+B![]() C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是
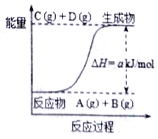
A. 产物C的能量高于反应物的总能量
B. 若该反应中有电子得失,则可设计成原电池
C. 反应物的总能量低于生成物的总能量
D. 该反应中的反应物A和B的转化率定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家发现正丁烷(![]() )脱氢或不完全氧化也可制得1,3-丁二烯(
)脱氢或不完全氧化也可制得1,3-丁二烯(![]() ),已知热化学方程式如下:( )
),已知热化学方程式如下:( )
①![]() =
=![]()
![]()
②![]() =
=![]()
![]()
③![]() =
=![]()
![]()
下列说法正确的是( )
A.由②可知,正丁烷(![]() )的燃烧热为
)的燃烧热为![]()
B.由①和②可推知:![]() =
=![]()
![]()
C.![]() =
=![]()
![]()
D.由①和②可知,同质量的正丁烷(![]() )转变为1,3-丁二烯(
)转变为1,3-丁二烯(![]() )所需要的能量相同
)所需要的能量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A和B中都充人2molX和2molY,起始VA=0.8a L,VB=a L保持温度不变,在有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)![]() 2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
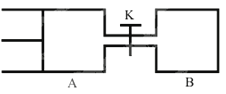
A. 两容器中达到平衡的时间A<B
B. 打开K达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定增大
C. A容器中X的转化率为25%,且比B容器中的X的转化率小
D. 打开K一段时间达平衡时,A的体积为0.8a L(连通管中的气体体积不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3),主要用作半导体硅的掺杂源或有机合成催化剂,还用于高纯硼或有机硼的制取。某兴趣小组用氯气和硼为原料,采用下列装置(部分装置可重复使用)制备BCl3。
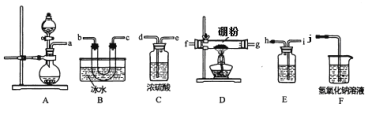
已知:①BCl3的沸点为12.5℃,熔点为-107.3℃;遇水剧烈反应生成硼酸和盐酸;②2B+6HCl ![]() 2BCl3+3H2;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3+3H2;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
请回答下列问题:
(1)A装置可用氯酸钾固体与浓盐酸反应制氯气,反应的化学方程式为___________。
(2)装置从左到右的接口连接顺序为a→___________________→j。
(3)装里E中的试剂为___________,如果拆去E装置,可能的后果是____________。
(4)D装置中发生反应前先通入一段时间的氯气,排尽装置中的空气。若缺少此步骤,则造成的结果是_____。
(5)三氯化硼与水能剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式________,硼酸也可用电渗析法制备,“四室电渗析法”工作原理如图所示:
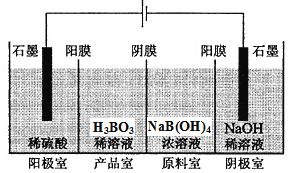
则阳极的电极反应式__________________,分析产品室可得到H3BO3的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________。
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol-1)___________。
(3)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)实验数据如表:
①请填写下表中的空白:
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
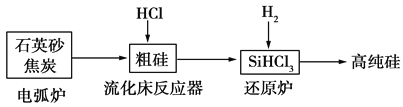
下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实或数据能说明次氯酸为弱电解质的是
A. 次氯酸具有漂白性 B. 常温时,次氯酸水溶液的pH < 7
C. 次氯酸不稳定,易分解 D. 0.001 molL-1 HClO溶液的pH = 5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com