
【题目】如图是一种可充电锂电池,反应原理是4Li+FeS2![]() Fe+2Li2S,LiPF6是电解质,SO(CH3)2是溶剂。下列说法正确的是( )
Fe+2Li2S,LiPF6是电解质,SO(CH3)2是溶剂。下列说法正确的是( )
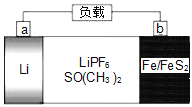
A.放电时,电子由a极经电解液流向b极
B.放电时,电解质溶液中PF6-向b极区迁移
C.充电时,b极反应式为Fe+2Li2S-4e-=FeS2+4Li+
D.充电时,b极消耗5.6gFe时在a极生成0.7gLi
【答案】C
【解析】
由所给的反应原理可判断原电池时,Li易失电子作负极,所以a是负极、b是正极,负极反应式为Li-e-═Li+,LiPF6是电解质,则正极反应式为FeS2+4Li++4e-═Fe+2Li2S。
A.电子从负极沿导线流向正极,电子不经过电解质溶液,A错误;
B.原电池中阴离子移向负极,电解质溶液中PF6-应向a极区迁移,B错误;
C.充电时,原电池中负极变阴极,正极变阳极,则电解时b极为阳极,反应式为Fe+2Li2S-4e-=FeS2+4Li+,C正确;
D. 由所给原理4Li+FeS2![]() Fe+2Li2S,可得关系式
Fe+2Li2S,可得关系式![]() ,b极消耗5.6gFe时在a极生成2.8gLi,D错误;
,b极消耗5.6gFe时在a极生成2.8gLi,D错误;
故选C。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 室温下,1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
B. 25℃时,0.1mol L-1的HA溶液中![]() = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,BaSO4在水中有沉淀和溶解的平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_____△H2(填“>”“<”或“=”,下同)。
(2)相同条件下,1 mol P4所具有的能量_______4 mol P原子所具有的能量。
(3)己知P4(白磷,s)![]() 4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
①P4(白磷,s)+5O2(g)=P4O10(s) △H1,
②4P(红磷,s)+5O2(g)=P4O10(s) △H2。
(4)己知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ· mol-1,则浓硫酸与稀氢氧化钠溶液反应生成2 mol水,放出的热量______114.6kJ。
(5)己知:28gFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了a kJ热量,该反应的热化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___,基态D原子价电子的轨道表达式为___,DA2分子的VSEPR模型是___。
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图1所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
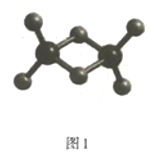
①C2Cl6属于___晶体(填晶体类型),其中C原子的杂化轨道类型为___杂化。
②[C(OH)4]-中存在的化学键有___。
③C2Cl6与过量的NaOH溶液反应的化学方程式为___。
(3)B、C的氟化物晶格能分别是2957kJmol-1、5492kJmol-1,二者相差很大的原因是___。
(4)D与E所形成化合物晶体的晶胞如图2所示。
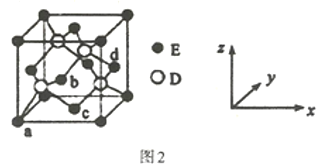
①在该晶胞中,E的配位数为___。
②已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为___pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H的分子中含有醛基和酯基。H可以用C和F在一定条件下合成(如图):
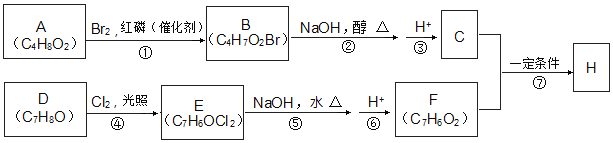
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②RCH2COOH 。
。
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的名称为___。
(2)D的官能团名称为___。
(3)反应②的化学方程式为__,⑦的反应类型为___。
(4)F的结构简式为__。
(5)H在一定条件下反应生成高聚物的化学方程式为___。
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②不能使FeCl3溶液显色,共有__种(不考虑立体异构)。其中能与碳酸氢钠溶液反应且核磁共振氢谱为4组峰,且峰面积比为3:2:2:1,写出G的这种同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硝酸钙的工业废水常含有 NH4NO3,可用电解法净化。其工作原理如图所 示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的()
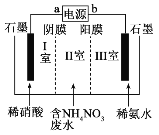
A.a 极为电源正极,b 极为电源负极
B.装置工作时电子由 b 极流出,经导线、电解槽 流入 a 极
C.I 室和 III 室最终均能得到副产品 NH4NO3
D.阴极电极反应式为 2NO3-+12H++10e-==N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作空气电极(图1),设计并组装出一种轻型、能折叠的可充电锂空气电池,其工作原理如图2所示。下列有关说法正确的是

A.闭合开关K给锂电池充电,X为直流电源负极
B.放电时,纸张中的纤维素作锂电池的正极
C.放电时,Li+由正极经过液相有机电解质移向负极
D.充电时,阳极的电极反应式为Li2O2+2e -=O2↑+2Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com