
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是( )
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
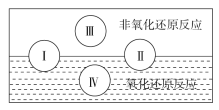
试写出有水参加的符合反应类型Ⅳ的一个离子反应方程式: ,其中水为________剂。
(3)氯化铵常用于焊接。如在焊接铜器时用过量的浓氯化铵溶液除去铜器表面的氧化铜以便焊接,其反应为:____CuO+____NH4Cl![]() ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。(配平时系数为“1”必须写出)
②该反应中,被氧化的元素是________(填元素名称),氧化剂是____________(填化学式)。
③往反应后的热溶液中加入过量澄清的石灰水,发现有气泡产生和蓝色沉淀生成,写出两个相应现象的离子方程式: 。
【答案】(1)C
(2)2Na+2H2O===2Na++OH-+H2↑,水做氧化剂。
(3)①4CuO+2NH4Cl![]() 3Cu+ 1 CuCl2+ 1 N2↑+4H2O ②氮 CuO
3Cu+ 1 CuCl2+ 1 N2↑+4H2O ②氮 CuO
③NH4++OH-![]() NH3↑+H2O Cu2++2OH-=Cu(OH)2↓
NH3↑+H2O Cu2++2OH-=Cu(OH)2↓
【解析】
试题分析:(1)煤的形成过程、卫星上太阳能电池的工作过程及我国古代烧制陶器的过程中都涉及有氧化还原反应,而简单的机械织布过程中无氧化还原反应,故答案C;(2)由“四种基本反应类型与氧化还原反应关系图”可知,I为化合反应(或分解反应),Ⅱ为分解反应(或化合反应),Ⅲ为复分解反应,Ⅳ为置换反应;有水参加的置换反应有很多,比如Na与水的反应,离子方程式为:2Na+2H2O===2Na++OH-+H2↑,在该反应中,水作氧化剂;(3)①利用氧化还原反应的得失电子守恒,并结合原子守恒、电荷守恒可配平化学方程式:4CuO+2NH4Cl![]() 3Cu+ 1 CuCl2+ 1 N2↑+4H2O;②在该反应中,铜元素化合价降低,被还原,CuO作氧化剂,Cu是还原产物;氮元素化合价升高,被氧化,NH4Cl作还原剂,N2是氧化产物;因此被氧化的元素是氮元素,氧化剂是CuO;③往反应后的热溶液中加入过量澄清的石灰水,发现有气泡产生和蓝色沉淀生成,证明生成了NH3和Cu(OH)2沉淀,化学方程式分别为:NH4++OH-
3Cu+ 1 CuCl2+ 1 N2↑+4H2O;②在该反应中,铜元素化合价降低,被还原,CuO作氧化剂,Cu是还原产物;氮元素化合价升高,被氧化,NH4Cl作还原剂,N2是氧化产物;因此被氧化的元素是氮元素,氧化剂是CuO;③往反应后的热溶液中加入过量澄清的石灰水,发现有气泡产生和蓝色沉淀生成,证明生成了NH3和Cu(OH)2沉淀,化学方程式分别为:NH4++OH-![]() NH3↑+H2O,Cu2++2OH-=Cu(OH)2↓。
NH3↑+H2O,Cu2++2OH-=Cu(OH)2↓。


科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是
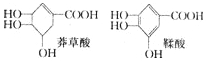
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.鞣酸分子中,可能在同一平面上的原子最多有14个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“脑黄金”是一种不饱和程度很高的脂肪酸,它的分子中含有六个碳碳双键,学名二十六碳六烯酸,它的分子组成应是
A. C25H51COOH B. C25H39COOH C. C26H41COOH D. C26H47COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 1mol乙烷在光照条件下最多能与3molCl2发生取代反应
B. 石油裂解气能使溴的四氯化碳溶液,酸性KMnO4溶液褪色
C. 水煤气可用来合成液态烃及甲醇等含氧有机物
D. 苯可通过取得反应制得硝基苯、氯苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金刚石和石墨互为同素异构体,熔点和硬度都很高
B. 氕、氘、氚是氢元素的三种核素,质子数都为1
C. 乙醇和二甲醚(CH3—O—CH3)互为同系物
D. C4H10的一氯取代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦因发现青蒿素对疟疾的治疗作用而成为2015年诺贝尔生理医学奖获得者之一。下列有关说法不正确的是

A.用萃取的方法,从青蒿中提取青蒿素。萃取是一种化学变化
B.青蒿素的分子式为C15H22O5,它属于有机物
C.经过长期的实验探索,终于获得成功,实验是化学研究的重要手段之一
D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C、H、O三种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体元素和化合物的叙述,正确的是
A. C是构成细胞的最基本元素,因为碳链是构成生物大分子的骨架
B. 细胞中的微量元素因含量极少而不如大量元素重要
C. 细胞中的脱氧核苷酸和脂肪都不含有氮元素
D. 蔗糖和麦芽糖彻底水解后,得到的产物是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,下列说法正确的是
A. 32g O2所含的原子数目为2NA
B. 11.2L H2O含有的原子数目为1.5NA
C. 1mol的Cl—含NA个电子
D. 0.5mol/L的NaCl溶液中Cl—的个数为是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。
⑴用“双线桥法”标出电子转移情况
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑵若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com