
下列离子反应方程式正确的是
A.氯气溶于水:Cl2+H2O═2H++ Cl﹣+ClO-
B.Fe2+与NO3-在酸性溶液中的反应: Fe2++NO3-+4H+=Fe3++NO↑+2H2O
C.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.浓 硝酸中加入铜片: Cu+4H++2NO3-═Cu2++2NO2↑+2H2O
硝酸中加入铜片: Cu+4H++2NO3-═Cu2++2NO2↑+2H2O
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
已知A(g)+B(g) 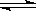 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g) 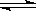 A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
保健医生提示:胃酸过多的人,应少食苹果,那么苹果汁的pH( )
A.大于7 B.等于7 C.小于7  D.无法判断
D.无法判断
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上定时训练(七)化学试卷(解析版) 题型:选择题
某金属单质跟一定浓度的硝酸反应,假定只有单一的还原产物,当参加反应的金属与被还原的HNO3的物质的量之比为2:1时,还原产物是
A.NO2 B.NO C.N2O D.N2
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月月考化学试卷(解析版) 题型:实验题
以下是有关SO2、Cl2的性质实验。
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
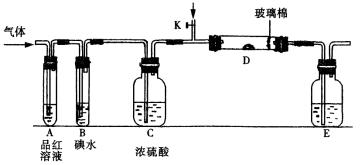
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,碘水褪色,则该反应的离子方程式为 。
③E中盛有______________溶液。
某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.硝酸钠溶液 C.氯化钙溶液
若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:填空题
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:



回答下列问题:
(1)在反应器 A 中通入的 X 是 。
(2)反应①和②分别在装置 和 中进行。(填装置符号)
(3)在分解釜 C中加入的Y为少量浓硫酸,其作用是 ,优点是用量少,缺点是 。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度应控制在 50~60℃,温度过高的安全隐患是 。
(5)中和釜 D 中加入的 Z 最适宜的是 (填序号。已知苯酚是一种弱酸)。
A.NaOH B.CaCO3 C.NaHCO3 D.CaO
(6)蒸馏塔 F 中的馏出物 T 和 P 分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:选择题
下列离子方程式,书写正确的是
A.用惰性电极电解熔融氯化钠:2Cl-+ 2H2O Cl2↑+ H2↑+ 2OH-
Cl2↑+ H2↑+ 2OH-
B.铁粉溶于稀硫酸:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.用 CuSO4 溶液吸收 H2S:Cu2+ + H2S = CuS↓+ 2H+
D.向 NH4HSO4 溶液中滴加少量的 Ba(OH)2 溶液:NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3•H2O+H2O
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+ 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
B.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO
C.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO
D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++ 2Br-+2Cl2=2Fe3++4Cl-+Br2
查看答案和解析>>
科目:高中化学 来源:2017届河北邯郸市高三上学期第二次月考化学试卷(解析版) 题型:实验题
课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
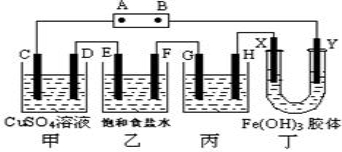
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:_________________。
(3)设电解质溶液过量,则同一时间内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com