
| m质 |
| m液 |
| V |
| Vm |
| n | ||
|
| 204g |
| 920g |
| 3.36L |
| 22.4L/mol |
| 0.15mol | ||
|


科目:高中化学 来源: 题型:
| A、1molNH4+和1molOH-所含电子数均为10NA |
| B、14gC2H4和14gC3H6 所含原子数均为3NA |
| C、1L l mol/LH2SO4溶液与Zn反应生成22.4L |
| D、标准状况下,11.2LSO3所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
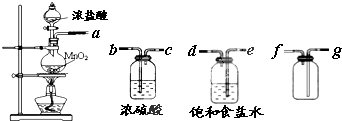
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | 固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 序号 | 实验操作 | 预期现象 | 结论 |
| Ⅰ | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,然后滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 样品含NaCl | |
| Ⅱ | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
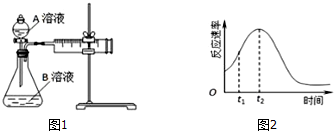
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com