
����Ŀ��KMnO4��ʵ���Һ�ҵ�Ͼ�����ҪӦ�ã��乤ҵ�Ʊ��IJ��ֹ������£�
�����̿�(��Ҫ�ɷ�MnO2)�������KOH�����ϣ�ͨ�������ֱ��գ����ɰ���ɫ����̬���ʡ�
����ȴ����������ϸ����ϡKOH��Һ��ȡ�����ˣ��ð���ɫ��Һ��
������ɫ��Һ��ͨ��CO2����Һ��Ϊ�Ϻ�ɫ��ͬʱ���ɺ�ɫ���塣
�������ˣ����Ϻ�ɫ��Һ����Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ������KMnO4���塣
���ϣ�K2MnO4Ϊ����ɫ���壬��ǿ������Һ���ȶ����ڽ����Ի�������Һ�������绯��Ӧ(Mn�Ļ��ϼۼ������ֽ���)��
(1)���У��������̿��Ŀ����_____��
(2)���У�����K2MnO4�Ļ�ѧ����ʽ��_____��
(3)���У���ȡʱ��ϡKOH��Һ��ԭ����_____��
(4)���У�CO2��K2MnO4����Һ�з�Ӧ�Ļ�ѧ����ʽ��_____��
(5)��K2MnO4��Һ���ö��Ե缫��Ĥ����⣬Ҳ���Ƶ�KMnO4��װ����ͼ��
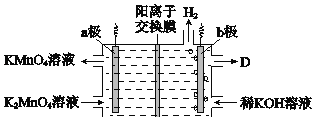
��b����_____��(����������������)��D��____________��
�ڽ�ϵ缫��Ӧʽ��������KMnO4��ԭ����___________��
�۴�ͳ��Ĥ�����ʱ����Ԫ��������ƫ�ͣ���֮��ȣ��������ӽ���Ĥ���������Ԫ�ص������ʣ���ԭ����__________��
(6)�õζ����ⶨij������ز�Ʒ�Ĵ��ȣ��������£�
��֪��Na2C2O4 +H2SO4 �TH2C2O4 +Na2SO4
5H2C2O4 +2MnO4��+6H+�T2Mn2++10CO2��+8H2O
Ħ��������Na2C2O4 134g/mol KMnO4 158g/mol
������ȡag��Ʒ�����50mL��Һ��
������ȡbgNa2C2O4��������ƿ�У�������ˮʹ���ܽ⣬�ټ�����������ᡣ
��������ƿ����Һ���ȵ�75�桫80�棬���£��â���������Һ�ζ����յ㣬������ҺV mL(���ʲ����뷴Ӧ)��
��Ʒ��KMnO4�����������ı���ʽΪ_________��
���𰸡�����Ӧ��Ӵ�������ӿ췴Ӧ���� 2MnO2 +4KOH+O2 ![]() 2K2MnO4 +2H2O ������Һ��ǿ���ԣ���ֹK2MnO4�����绯��Ӧ 3K2MnO4 +2CO2 =2KMnO4 +MnO2��+2K2CO3 �� ��Ũ��KOH��Һ a����MnO42--e-=MnO4-������K+ͨ�������ӽ���Ĥ����������������������KMnO4 �������ӽ���Ĥ�ɷ�ֹMnO4����MnO42������������ԭ
2K2MnO4 +2H2O ������Һ��ǿ���ԣ���ֹK2MnO4�����绯��Ӧ 3K2MnO4 +2CO2 =2KMnO4 +MnO2��+2K2CO3 �� ��Ũ��KOH��Һ a����MnO42--e-=MnO4-������K+ͨ�������ӽ���Ĥ����������������������KMnO4 �������ӽ���Ĥ�ɷ�ֹMnO4����MnO42������������ԭ ![]()
��������
(1)�������̿��������������
(2)�������֪���̿�(��Ҫ�ɷ�MnO2)�������KOH�����ϣ�ͨ�������ֱ��գ�������K2MnO4��
(3)��ϡKOH��Һ��ȡ����ʹ��Һ��ǿ���ԣ���ֹK2MnO4���ʣ�
(4)���У�CO2��K2MnO4����Һ�з�Ӧ����Һ��Ϊ�Ϻ�ɫ��ͬʱ���ɺ�ɫ���壬˵������KMnO4��MnO2��
(5)���K2MnO4��ȡKMnO4��������ˮ�õ��ӷ�����ԭ��Ӧ�������������������ӣ����������������ʧ���ӷ�Ӧ������Ӧ���ɸ���������ӣ�
(6)��ȡbgNa2C2O4��������ƿ�У���֪n(Na2C2O4)=![]() ���â���������Һ�ζ����յ㣬������ҺV mL���ɷ���ʽ5H2C2O4+2MnO4-+6H+=2Mn2++10CO2��+8H2O��֪VmL��Һ��n(KMnO4)���������㴿�ȡ�
���â���������Һ�ζ����յ㣬������ҺV mL���ɷ���ʽ5H2C2O4+2MnO4-+6H+=2Mn2++10CO2��+8H2O��֪VmL��Һ��n(KMnO4)���������㴿�ȡ�
(1)�������̿����������������Ӧ��ĽӴ����������Ӧ���ʼӿ죻
(2)�������֪���̿�(��Ҫ�ɷ�MnO2)�������KOH�����ϣ�ͨ�������ֱ��գ�������K2MnO4����Ӧ�ķ���ʽΪ2MnO2+4KOH+O2![]() 2K2MnO4+2H2O��
2K2MnO4+2H2O��
(3)�������֪��ϡKOH��Һ��ȡ����ʹ��Һ��ǿ���ԣ���ֹK2MnO4�����绯��Ӧ�����ʣ�
(4)���У�CO2��K2MnO4����Һ�з�Ӧ����Һ��Ϊ�Ϻ�ɫ��ͬʱ���ɺ�ɫ���壬˵������KMnO4��MnO2����Ӧ�ķ���ʽΪ3K2MnO4+2CO2=2KMnO4+MnO2��+2K2CO3��
(5)����ͼ��֪b������������Ӧ������ԭ��Ӧ��Ϊ���������������ɵõ���Ũ��KOH��Һ��
��aΪ���������������������ʧ���ӷ�Ӧ������Ӧ���ɸ���������ӣ�����MnO42--e-=MnO4-��ͬʱ����K+ͨ�������ӽ���Ĥ����������������������KMnO4��
���������ӽ���Ĥ�ɷ�ֹMnO4-��MnO42-����������ԭ�������Ԫ�ص������ʣ�
(6)��ȡbgNa2C2O4��������ƿ�У���֪n(Na2C2O4)=![]() mol���â���������Һ�ζ����յ㣬������ҺV mL���ɷ���ʽ5H2C2O4+2MnO4-+6H+=2Mn2++10CO2��+8H2O��֪VmL��Һ��n(KMnO4)=
mol���â���������Һ�ζ����յ㣬������ҺV mL���ɷ���ʽ5H2C2O4+2MnO4-+6H+=2Mn2++10CO2��+8H2O��֪VmL��Һ��n(KMnO4)=![]() mol��
mol��![]() ����50mL��Һ��n(KMnO4)=
����50mL��Һ��n(KMnO4)=![]() mol��
mol��![]() ������m=
������m=![]() mol��
mol��![]() ��158g/mol=
��158g/mol=![]() g�����Ʒ��KMnO4����������Ϊ
g�����Ʒ��KMnO4����������Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ���� ( )
A. 0.3 mol��L-1A1(NO3)3��Һ�к�A13+��С��0.3 NA
B. H2(g)+I2(g)![]() 2HI(g) ��H= - akJ��mol-1�����ܱ������м���NA������Ӻ�NA������ӣ���ַ�Ӧ��ų�������ΪakJ
2HI(g) ��H= - akJ��mol-1�����ܱ������м���NA������Ӻ�NA������ӣ���ַ�Ӧ��ų�������ΪakJ
C. ���³�ѹ�£�28 g C2H4��CO�Ļ�������к���̼ԭ�ӵ���ĿΪ1.5NA
D. ��״���£� Zn��H2SO4(1mol��L-1)��Cuԭ����У���������1.12 L H2ʱ��ת�Ƶĵ�����Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���ڹ�ҵ�������й㷺��;���л��߷��ӽṹƬ����ͼ�����й��ڸø߷��ӵ�˵����ȷ����

A. ��ˮ���С����
B. ����ֻ����һ�ֹ�����
C. ����Ըø߷��ӵ�����û��Ӱ��
D. �ṹ��ʽΪ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ���ʺͻ�ѧƽ��Ӱ���ͼ������ͼ���ʵ����۱���������




A. a����������һ��ʱ����Ӧ�������¶ȱ仯��ͼ������Ӧ��H > 0
B. b���������������½�����ƽ�����ͼ����ʹ�ô���ʱ������
C. c��һ�������£�����һ����A������������Bʱ��ͼ��ѹǿp1 > p2
D. d����ƽ����ϵ����Һ����������KCl�����ѧ��Ӧ������ʱ��仯��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״�����У���6.72LCH4����3.01��1023��HCl���ӣ���13.6gH2S����0.2molNH3�����ж������������������ȷ���ǣ� ��
a�������>��>��>�� b���ܶȢ�>��>��>��
c��������>��>��>�� d����ԭ�Ӹ�����>��>��>��
A.abcB.bcdC.cbdD.abcd
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ������ش��������⣺
��1���۲���ͼ������Һ����Ӧ����___________�ζ����С�����ס����ҡ���


��2���ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע��__________________________________���ζ��յ������Ϊ_______________��
��3�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ������ͼ���ң���ʾ������ʼ����Ϊ___________mL������������Һ�����Ϊ___________________mL��
��4��ijѧ������3��ʵ��ֱ��¼�й����������ʾ��

���ݱ������ݼ����NaOH��Һ�����ʵ���Ũ��________________��
��5�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵���_____________(����ĸ���)��
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ���Ʊ�������Cl2�����ʡ�����˵����ȷ����
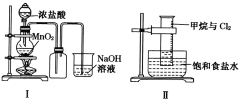
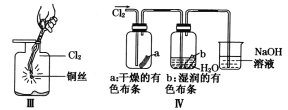
A. Iͼ�У����MnO2������Ũ����Ϳ�ȫ��������
B. IIͼ�У���Ͳ�з����˼ӳɷ�Ӧ
C. IIIͼ�У�������ɫ����
D. IVͼ�У�ʪ�����ɫ��������ɫ��������Һ�����ձ��У�����Һ�����ԣ������Cl2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�ʴ��Һ(��FeCl2��CuCl2��FeCl3)�Ʊ�����ʴ��Һ[Cu(NH3)4Cl2��Һ]��FeCl3��6H2O����Ҫ��������H2O2������ʴ��Һ���Ʊ��������Ʊ�����ʴ��Һ[CuCl2+4NH3=Cu(NH3)4Cl2]����Һ�������������ܽ�������Ʊ�FeCl3��6H2O������ʵ��ԭ����װ�������ﵽʵ��Ŀ�ĵ���
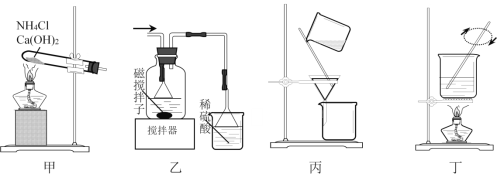
A. ��װ�ü��Ʊ�NH3
B. ��װ�����Ʊ�Cu(NH3)4Cl2������
C. ��װ�ñ�����Cu(NH3)4Cl2��Һ��Fe(OH)3
D. ��װ�ö���FeCl3��Һ�����Ʊ�FeCl3��6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش���������:
(1) O2��O3����Ԫ�ص����ֵ��ʡ����ݷ���ʽ�ش�
��������O2��O3�����ʵ���֮��Ϊ________,����������֮��Ϊ________,ԭ�Ӹ�����Ϊ____________��
(2) NO2��N2O4�ǵ�Ԫ�ص����ֳ���������,�����¶�������,����֮���ڳ����¾����ת��,�����������������������Ļ�����ȡ46 g������,������ԭ�ӵ����ʵ���Ϊ________,������ԭ�Ӹ���Ϊ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com