
【题目】COCl2的分解反应为COCl2(g)![]() Cl2(g)+CO(g)。将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的物质的量在不同条件下的变化情况如下图所示。
Cl2(g)+CO(g)。将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的物质的量在不同条件下的变化情况如下图所示。

下列相关说法中不正确的是
A.1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率
B.若在6min时改变的条件为升高温度,则反应的平衡常数K增大
C.12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积
D.以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13)
【答案】D
【解析】
试题分析:A.1min时反应尚未达平衡且此时反应正向进行为主,CO的速率呈增大趋势,故以CO表示的逆反应速率小于3min时以CO表示的正反应速率,故A正确;B.在6min时改变的条件为升高温度,由图像可知平衡正向进行,则反应的平衡常数K增大,故B正确;C.12min时由图像可知,CO的速率瞬间减小,平衡正向移动,可推知改变的条件可为减小CO的浓度;可逆反应COCl2(g)![]() Cl2(g)+CO(g)如果增大反应容器的体积,平衡正向移动,则由图像可知16min时改变的条件可为增大反应容器的体积,故C正确;D.平衡状态从4~5min到10~11min时是升高温度,反应速率加快,平衡后减少CO的浓度,此时速率应该降低,则CO表示在10~11min时和12~13min时平均反应速率为v(10~11)>v(12~13),故D错误;答案为D。
Cl2(g)+CO(g)如果增大反应容器的体积,平衡正向移动,则由图像可知16min时改变的条件可为增大反应容器的体积,故C正确;D.平衡状态从4~5min到10~11min时是升高温度,反应速率加快,平衡后减少CO的浓度,此时速率应该降低,则CO表示在10~11min时和12~13min时平均反应速率为v(10~11)>v(12~13),故D错误;答案为D。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)达到平衡时,c(H2) =0.5mol·L-1,c(HI)=5mol·L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g)达到平衡时,c(H2) =0.5mol·L-1,c(HI)=5mol·L-1,则此温度下反应①的平衡常数为
A.36 B.30 C.25 D.20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能。下列关于碳纳米管的说法不正确的是
A.碳纳米管属于一种有机合成纤维
B.碳纳米管与金刚石互为同素异形体
C.常温下,碳纳米管具有较好的稳定性
D.碳纳米管比表面积大,可用作新型储氢材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 金属元素的最外层电子数不一定小于4
B. 1A族元素形成的单质的熔点随原子序数的递增而降低
C. 同主族第三、第四周期的元素原子序数之差不一定等于18
D. 单质磷的化学性质比氮气活泼,容易与非金属等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0,下列叙述正确的是
4NO(g)+6H2O(g) △H<0,下列叙述正确的是
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验事实所作结论中,正确的是( )
实验事实 | 结论 | |
A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
⑴Ga的原子结构示意图为 ___________________。
⑵GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式 。
⑶下列有关镓和镓的化合物的说法正确的是____ 。
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
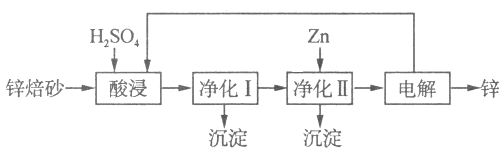
已知:Fe的活泼性强于Ni
⑷ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为 。
⑸净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
⑹净化II中加入Zn的目的是___________________。
⑺常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3] = 8.0 × 10-38;lg5 = 0.7
查看答案和解析>>
科目:高中化学 来源: 题型:
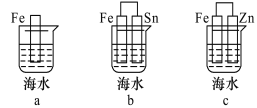
【题目】(1)下列各情况中, Fe片被腐蚀的速率由快到慢的顺序是 (填字母)。
(2)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2 = 2H2O,完成下列问题:
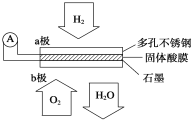
① 电子通过外电路从 极流向 极(填a或b)。
② b极上的电极反应式为: 。
③ 每转移0.1 mol电子,消耗H2的体积为 L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com