
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________;
(2)实验③中的现象为_____________________________________________________;
(3)实验①、②中反应的离子方程式分别是__________、________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(6分)某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
(1)混合物加水得无色透明溶液;
(2)向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
(3)上述白色沉淀可完全溶于稀盐酸;
(4)将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
(5)将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中①肯定含有_______,②不能确定是否含有 _________,③一定不含有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有: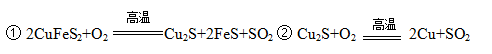
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。
(2)反应②中还原剂是 。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。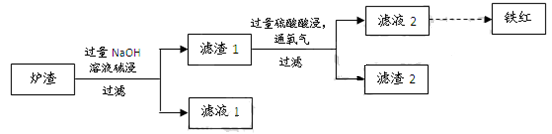
① 炉渣碱浸时反应的离子方程式是 、 。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: 。
(2)下列三种情况下,离子方程式与 (1)相同的是 (填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的 (填序号)曲线表示。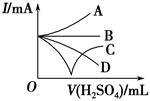
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。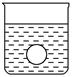
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下: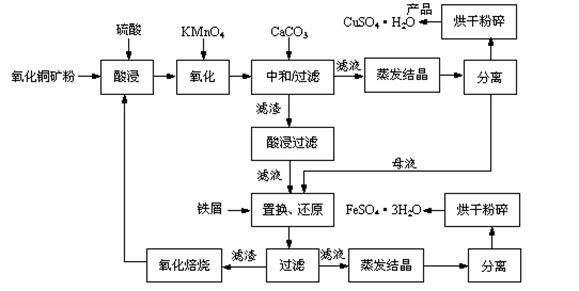
(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)加入铁屑的作用是 、 。
(6)下表和下图为“烘干粉碎”的试验结果。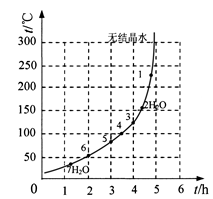
硫酸亚铁干燥曲线图
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为 。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。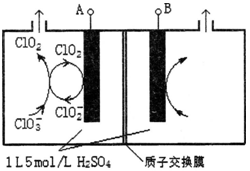
①电源负极为 极(填A或B):
②写出阴极室发生反应依次为: 、
;
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2﹣歧化反应。若两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),此时阳极室与阴极室c(H+)之差为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | | ||
| 第一次 | 第二次 | 第三次 | ||
| 0.02 | 14 | 13 | 11 | |
| 0.002 | 6.7 | 6.6 | 6.7 | |
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
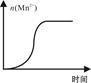
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂用软锰矿(含MnO2约70%及Al2 O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2,和Zn(干电池原料)。流程如下: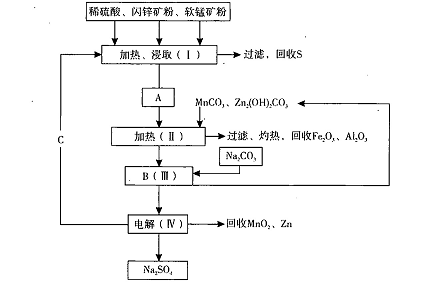
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3,Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O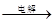 MnO2+Zn +2H2SO4。
MnO2+Zn +2H2SO4。
(1)A中属于还原产物的是 。
(2)加入MnCO3、Zn2(OH)2CO3的作用是 :C的化学式是 。
(3)该生产中除得到Na2SO4、S等副产品外,还可得到的副产品是 。
(4)副产品S可用于制硫酸,转化过程是:S→SO2→SO3→H2SO4。写出第二步转化的化学方程式 。
(5)要从Na2SO4溶液中得到芒硝( Na2SO4.10H2O),需进行的操作有蒸发浓缩、 、
过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿投料的质量比大约是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知 0.4 mol 液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64 kJ的热量。
(1)写出肼和H2O2反应的热化学方程式: 。
(2)已知H2O(l)=H2O(g) ΔH="+44" kJ/mol,则16 g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
(3)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是 。
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: ,该反应的还原产物是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com