
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
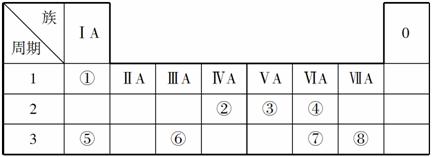
(1)请画出元素⑥的离子结构示意图:________。
(2)元素⑦中质子数和中子数相等的同位素符号是____________。
(3)④⑤⑦的简单离子半径由大到小的顺序为____________。
(4)②的最高价氧化物对应水化物的电离方程式为__________________。
(5)④⑤两种元素的原子按1:1组成的常见化合物的电子式为________。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为____________________。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16 g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量,写出A与B反应的热化学方程式________________。
解析 根据元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为S,⑧为Cl。(3)S2-有三个电子层,半径最大;核外电子排布相同的离子,随核电荷数的增多,半径减小,即O2-的半径大于Na+的半径,故离子半径大小顺序为S2->O2->Na+。(4)H2CO3为二元弱酸,分步电离,其电离方程式为H2CO3HCO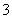 +H+、HCO
+H+、HCO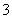 CO
CO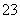 +H+。(5)Na2O2为离子化合物,其电子式为:Na+[:
+H+。(5)Na2O2为离子化合物,其电子式为:Na+[: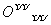 :
: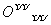 :]Na+。(6)5核10电子的物质为CH4,在燃料电池中发生氧化反应,作负极,其电极反应为CH4-8e-+10OH-===CO
:]Na+。(6)5核10电子的物质为CH4,在燃料电池中发生氧化反应,作负极,其电极反应为CH4-8e-+10OH-===CO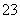 +7H2O。(7)火箭发动机燃料为肼,分子式为N2H4,含有18个电子的常见强氧化剂为H2O2,根据题目信息可写出该反应的热化学方程式为N2H4(l)+2H2O2(l)===4H2O(l)+N2(g)
+7H2O。(7)火箭发动机燃料为肼,分子式为N2H4,含有18个电子的常见强氧化剂为H2O2,根据题目信息可写出该反应的热化学方程式为N2H4(l)+2H2O2(l)===4H2O(l)+N2(g)
ΔH=-1 676 kJ/mol。
答案 (1)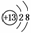
(2)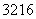 S(或32S)
S(或32S)
(3)S2->O2->Na+
(4)H2CO3HCO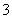 +H+、HCO
+H+、HCO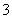 CO
CO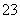 +H+
+H+
(5)Na+[: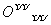 :
: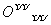 :]2-Na+
:]2-Na+
(6)CH4-8e-+10OH-===CO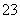 +7H2O
+7H2O
(7)N2H4(l)+2H2O2(l)===4H2O(l)+N2(g) ΔH=-1 676 kJ/mol


科目:高中化学 来源: 题型:
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且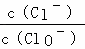 的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
|
| A. | 若某温度下,反应后 |
|
| B. | 参加反应的氯气的物质的量等于3a mol |
|
| C. | 改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol |
|
| D. | 改变温度,产物中KClO3的最大理论产量为a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:
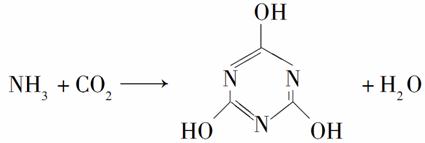
下列有关三聚氰酸的说法正确的是( )
A.分子式为C3H6N3O3
B.分子中既含极性键,又含非极性键
C .属于共价化合物
.属于共价化合物
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是( )
A.M元素存在同素异形体
B.M元素为非金属元素
C.M的最高价氧化物对应的水化物都是强酸
D.常温下,能稳定存在的M的氧化物都是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
现有如下仪器,仪器中已注入溶液,回答下列问题。
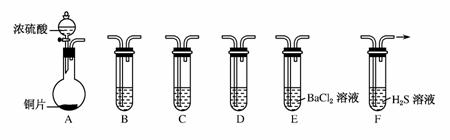
(1)加热装置A,写出铜与浓硫酸反应的化学方 程式_______________________________,烧瓶中的实验现象为________。
程式_______________________________,烧瓶中的实验现象为________。
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂为B________、C________、D________。能说明碳的非金属性比硅强的实验现象是______________________。
(3)验证SO2的氧化性、还原性。若选择A、E、F仪器,并按A、E、F顺序连接。
①则证明SO2有氧化性的实验现象是______________________,反应方程式为______________________________。
②若证明SO2具有还 原性,在E中采取的实验操作为________,其实验现象为________,反应原理为____________________(用离子方程式表示)。
原性,在E中采取的实验操作为________,其实验现象为________,反应原理为____________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO、H2在一定条件下合成乙醇:2CO(g)+4H2(g)  CH3CH2OH(g)+H2O(g)是一个放热反应。下列说
CH3CH2OH(g)+H2O(g)是一个放热反应。下列说
法错误的是( )
A.反应物的总能量大于生成物的总能量
B.增大H2浓度可以使CO转化率达到100%
C.使用合适的催化剂、升高温度均可加大反应速率
D.反应达到平衡时,正反应和逆反应的化学反应速率相等且不为零
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年初,雾霾天气多次肆虐我
国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
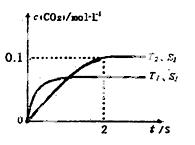
(l)汽车尾气净化的主要原理为: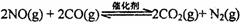 。 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。据此判断:
。 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。据此判断:
①该反应的ΔH______0(选填“>”、“<”)。
②该反应的平衡常数表达式为____________________
③在T2温度下,0 ~ 2s内的平均反应速率v(N2)_______。
④当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面 积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
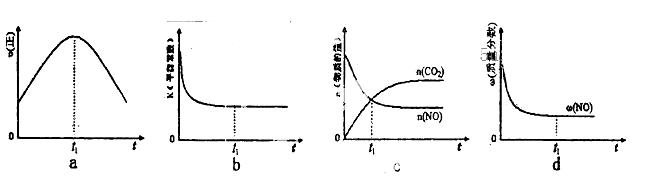
⑤该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。例如:
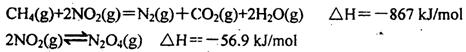
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 900 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=__________,ΔH______0(填“<”、“>”或“=”);
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为__________;
(3)1 200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为__________。
A(g)+B(g)的平衡常数的值为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com