
【题目】运用元素周期律分析下面的推断,其中错误的是![]()
A.铍![]() 的氧化物对应的水化物可能具有两性
的氧化物对应的水化物可能具有两性
B.砹![]() 为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于酸
为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于酸
C.硒化氢![]() 是无色、有毒且稳定性比硫化氢还差的气体
是无色、有毒且稳定性比硫化氢还差的气体
D.同一主族的元素从上到下,金属性呈周期性变化
科目:高中化学 来源: 题型:
【题目】如图是以石墨作阳极,铜棒作阴极,电解 200mL,含有 Cu2+、Fe3+离子的酸性溶液,阴极生成固体与转移电子的关系, 则以下说法正确的是( )
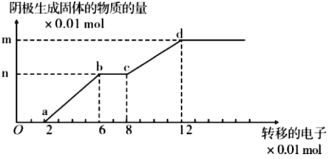
A.Oa 段、bc 段阴极均有气体产生
B.bc 段的电极反应为:Fe3++e-=Fe2+
C.原溶液 PH 值约为 1
D.该溶液中 Cu2+,Fe3+离子的浓度之比为 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是![]()
A.短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
B.铍的最高价氧化物的水化物可能具有两性
C.已知锶![]() 是第 IIA元素,碳酸锶难溶于水,但易溶于盐酸
是第 IIA元素,碳酸锶难溶于水,但易溶于盐酸
D.科学家在周期表中金属元素与非金属元素分界线处找到了优良的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实验操作能达到实验目的或能得出相应结论的是![]()
选项 | 实验操作 | 实验目的或结论 |
A | 向一定浓度的 |
|
B | 取少量 | 检验 |
C | 向某溶液中滴加 | 说明原溶液中一定含有 |
D | 将混有 | 除去 |
A.A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL0.1mol·L-1某一元碱中,逐滴加入0.1mol·L-1醋酸,滴定曲线如图所示。则下列说法正确的是( )

A.无法判断该碱溶液能否可以溶解Al(OH)3
B.a点对应的体积值等于25mL
C.C点时,c(CH3COO-)>c(Na+)>c(OH-) >c(H+)
D.D点时,c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如下图所示.下列说法正确的是
与溶液pH的关系如下图所示.下列说法正确的是

A.![]() 时,溶液中
时,溶液中![]()
B.![]() 时,溶液中
时,溶液中![]()
C.为获得尽可能纯的![]() ,可将溶液的pH控制在
,可将溶液的pH控制在![]() 左右
左右
D.由图中数据可估算出![]() 为
为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种物质之间的转化关系如图所示![]() 部分产物已略去
部分产物已略去![]() ,下列说法正确的是
,下列说法正确的是![]()

A.若A为![]() 溶液,B可能为氨水,反应
溶液,B可能为氨水,反应![]() 的离子方程式为:
的离子方程式为:![]()
B.若A为Fe,B可能为稀硝酸,反应![]() 的离子方程式为:
的离子方程式为: ![]()
C.若A为NaOH溶液,B可能为![]() ,可用
,可用![]() 溶液鉴别C、D溶液
溶液鉴别C、D溶液
D.若A为![]() ,B可能为
,B可能为![]() ,实验室可用加热固体C的方法制取
,实验室可用加热固体C的方法制取![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸是三元弱酸,常温下三级电离常数分别是:Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:
(1)常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序___(填序号)。
(2)常温下,NaH2PO4的水溶液pH___(填“>”“<”或“=”)7。
(3)常温下,Na2HPO4的水溶液呈___(填“酸”“碱”或“中”)性,用Ka与Kh的相对大小,说明判断理由:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯和碘是ⅦA元素,回答下列问题:
(1)I3-中心原子的价层电子对数为_______ ,沸点ICl____Cl2(填大于,小于,等于)。
(2)已知CsICl2受热分解,该分解的化学方程式是___________________。
(3)已知高碘酸的结构如图1所示,1mol高碘酸中含有__________mol![]() 键。
键。
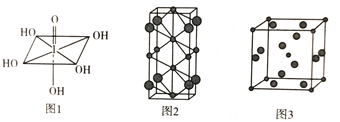
(4)Na和Cl两种元素可以形成不同类型的晶体,如图2和图3(大球为氯原子,小球为钠原子),图2化学式为_____________;图3中Na+的配位数为___________。
(5)若图3晶胞的边长为a cm,则晶体的密度![]() =____(NA表示阿伏加德罗常数的值)。
=____(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com