
下表为周期表的一部分,其中的编号代表对应的元素.
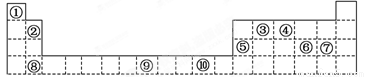
请回答下列问题:
(1)表中属于d区的元素是_____________(填编号)。
(2)写出元素⑨的基态原子的电子排布式_____________;
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为_____________对,其单质的电子式为_____________;
(4)元素④的氢化物的分子构型为_____________,中心原子的杂化方式为_____________;
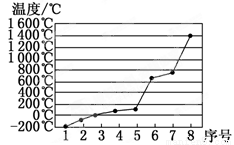
(5)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_____________(填元素符号);其中电负性最大的是_____________(填图中的序号)。
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
某非金属单质A和O2发生化合反应生成B。B为气体,其体积是参加反应的O2体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是
A.有1个氧原子 B.有2个氧原子
C.有1个A原子 D.有2个A原子
查看答案和解析>>
科目:高中化学 来源:2017届四川省新高三零诊模拟理综化学试卷(解析版) 题型:实验题
I.实验室制备、收集干燥的 SO2,所需仪器如下图。

(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为 a→___→___→___→___→f。
(2)验证产生的气体是 SO2的方法及实验现象是_________________________________。
(3)若在1 L 0.3 mol/L的 NaOH溶液中,通入4.48 L SO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+ c(H+)= c(HSO3-)+2 c(SO32-)+ c(OH-),请再写出两个等量关系: ________________。
II.SO2 气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:

(4)若要从FeCl3溶液中提取晶体,必须进行的实验操作步骤中没有用到的玻璃仪器有_________。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(5)装置 A 中的现象是_________________,写出 B 中发生反应的离子方程式:___________________。
(6)在上述装置中通入过量的 SO2,为了验证A中SO2与 Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入 KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是________。
查看答案和解析>>
科目:高中化学 来源:2017届四川省新高三零诊模拟理综化学试卷(解析版) 题型:选择题
用式量为57的烷烃基取代甲苯苯环上的一个氢原子,能得到的有机物种数为( )
A. 4种 B. 8种 C. 12种 D. 24种
查看答案和解析>>
科目:高中化学 来源:2017届四川省新高三零诊模拟理综化学试卷(解析版) 题型:选择题
下列物质的化学用语正确的是( )
A.NH4H 的电子式: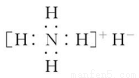
B.硝基苯的结构简式: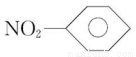
C.丙烯的实验式:CH2
D.甲烷分子的比例模型:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二实验班下期中化学卷(解析版) 题型:选择题
某单烯烃氢化后得到的饱和烃是: ,该烯烃可能的结构有( )
,该烯烃可能的结构有( )
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二实验班下期中化学卷(解析版) 题型:选择题
碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为( )
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:填空题
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示.回答下列问题:
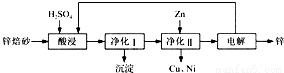
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为____________;
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀.
①写出酸性条件下H2O2与Fe 2+反应的离子方程式:____________;
②25℃时,pH=3的溶液中,c(Fe3+)= ____________mol•L-1(已知25℃,Ksp[Fe( OH)3]=4.0×10-38).
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________;
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是____________;
(4)本流程中可以循环利用的物质除锌外还有____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则一中高二月考化学试卷(解析版) 题型:选择题
下列固体投入水中,有气体产生的是
A.Na2O2 B.Na2O C.NaHCO3 D.Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com