
| A. |  | B. | 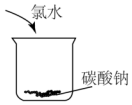 | C. |  | D. |  |
分析 A.HClO光照分解生成HCl和氧气;
B.氯水中含HCl,与碳酸钠反应;
C.氯水与NaBr反应生成NaCl和溴;
D.浓硫酸稀释放出大量的热,浓盐酸易挥发.
解答 解:A.HClO光照分解生成HCl和氧气,图中装置可生成氧气,故A不选;
B.氯水中含HCl,与碳酸钠反应,图中装置可生成二氧化碳气体,故B不选;
C.氯水与NaBr反应生成NaCl和溴,常温下溴为液体,不能观察到气体生成,故C选;
D.浓硫酸稀释放出大量的热,浓盐酸易挥发,图中装置可观察到HCl气体的逸出,故D不选;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质和发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向该容器中加入少量A,反应速率增大 | |
| B. | 向该容器中充入氩气,反应速率增大 | |
| C. | 将粉末状A代替块状A能加快反应 | |
| D. | 该反应为放热反应,无需加热即可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
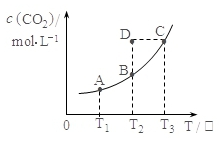 在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H 2O(g)?CO2(g)+H 2(g);CO 2(g)的平衡物质的量浓度c(CO 2)与温度T的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T 2时,若反应处于状态D,则一定有V 正<V 逆 | |
| C. | 反应CO(g)+H 2O(g)?CO 2(g)+H 2(g) 的△H>0 | |
| D. | 若T 1、T 2时的平衡常数分别为K 1、K 2,则K 1<K 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| B. | NaOH溶液吸收工业制硝酸的尾气:NO+NO2+2OH-═2NO3-+H2O | |
| C. | NH4HCO3溶液中滴加足量NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | KIO3溶液氧化KI的酸性溶液:IO3-+5I-+3H2O═3I2↓+6OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com