

| 33.0g |
| 36.96g |


科目:高中化学 来源: 题型:

| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据同周期元素的电负性变化趋势,推出Cl的电负性比S大 |
| B、根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
| D、根据强酸可以制取弱酸的规律,推出将HCl加入到AgNO3溶液中能制备HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
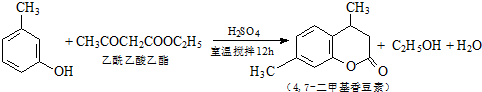
 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
查看答案和解析>>
科目:高中化学 来源: 题型:
 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:| 浓H2SO4 |
| 135度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热加压 |
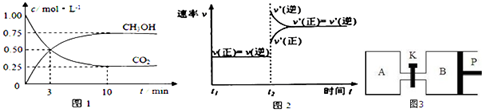
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol L -1 | 0.9 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该分子在1H核磁共振谱中有12个峰 |
| B、久置在空气中的普罗加比会因氧化而变质 |
| C、1 mol普罗加比最多可与3 mol NaOH反应 |
| D、一定条件下,1mol普罗加比最多能与2mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com