


 ŹĒŌ×ÓĄūÓĆĀŹĪŖ100%µÄ×Ŗ»Æ£¬¢ņµÄ½į¹¹¼ņŹ½ĪŖCH2=CH2£¬
ŹĒŌ×ÓĄūÓĆĀŹĪŖ100%µÄ×Ŗ»Æ£¬¢ņµÄ½į¹¹¼ņŹ½ĪŖCH2=CH2£¬ ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś¾ŪŗĻ·“Ӧɜ³É¾Ūõ£°·Ąąøß·Ö×Ó»ÆŗĻĪļ£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½
ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś¾ŪŗĻ·“Ӧɜ³É¾Ūõ£°·Ąąøß·Ö×Ó»ÆŗĻĪļ£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ £®
£® ””£©ĄūÓƱ¾ĢāµÄŠÅĻ¢£¬Éč¼ĘŗĻ³É·½°ø£¬ÓĆĮ÷³ĢĶ¼±ķŹ¾²¢×¢Ć÷·“Ó¦Ģõ¼ž£®ĄżČē£¬ÓÉŅŅ“¼ŗĻ³É¾ŪŅŅĻ©µÄ·“Ó¦Į÷³ĢĶ¼æɱķŹ¾ĪŖ£ŗ
””£©ĄūÓƱ¾ĢāµÄŠÅĻ¢£¬Éč¼ĘŗĻ³É·½°ø£¬ÓĆĮ÷³ĢĶ¼±ķŹ¾²¢×¢Ć÷·“Ó¦Ģõ¼ž£®ĄżČē£¬ÓÉŅŅ“¼ŗĻ³É¾ŪŅŅĻ©µÄ·“Ó¦Į÷³ĢĶ¼æɱķŹ¾ĪŖ£ŗ £¬Ōņ·“Ó¦µÄĮ÷³ĢĶ¼ĪŖ
£¬Ōņ·“Ó¦µÄĮ÷³ĢĶ¼ĪŖ $”ś_{¹āÕÕ}^{ĀČĘų}$
$”ś_{¹āÕÕ}^{ĀČĘų}$ $”ś_{”÷}^{ĒāŃõ»ÆÄĘČÜŅŗ}$
$”ś_{”÷}^{ĒāŃõ»ÆÄĘČÜŅŗ}$ $\stackrel{HCN}{”ś}$””
$\stackrel{HCN}{”ś}$”” $”ś_{H_{2}O}^{H+}$
$”ś_{H_{2}O}^{H+}$ $”ś_{”÷}^{ÅØH_{2}SO_{4}}$
$”ś_{”÷}^{ÅØH_{2}SO_{4}}$ £®
£® ·ÖĪö Óɼױ½Óė¶ŌĻõ»ł±½¼×ĖįµÄ½į¹¹¼ņŹ½æÉÖŖ£¬¼×±½·¢Éś¼×»ł¶ŌĪ»µÄĻõ»Æ·“Ӧɜ³ÉI£¬ŌņIĪŖ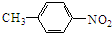 £¬
£¬ ŹĒŌ×ÓĄūÓĆĀŹĪŖ100%µÄ×Ŗ»Æ£¬ĖłŅŌ¢ņĪŖCH2=CH2£¬øł¾Ż¢õŗĶ¶Ō°±»ł±½¼×ĖįµÄ½į¹¹æÉÖŖ£¬¢ōĪŖ£ØC2H5£©2NCH2CH2OH£¬»·ŃõŅŅĶéÓė¢ó·¢ÉśŠÅĻ¢¢ŁµÄ·“Ӧɜ³É¢ō£¬ĖłŅŌ¢óĪŖ£ØC2H5£©2NH£¬¼×±½ĪŖŌĮĻŗĻ³É
ŹĒŌ×ÓĄūÓĆĀŹĪŖ100%µÄ×Ŗ»Æ£¬ĖłŅŌ¢ņĪŖCH2=CH2£¬øł¾Ż¢õŗĶ¶Ō°±»ł±½¼×ĖįµÄ½į¹¹æÉÖŖ£¬¢ōĪŖ£ØC2H5£©2NCH2CH2OH£¬»·ŃõŅŅĶéÓė¢ó·¢ÉśŠÅĻ¢¢ŁµÄ·“Ӧɜ³É¢ō£¬ĖłŅŌ¢óĪŖ£ØC2H5£©2NH£¬¼×±½ĪŖŌĮĻŗĻ³É £¬æÉŅŌÓĆ¼×±½ÓėĀČĘų·“Ӧɜ³É¶žĀČ¼×±½£¬¶žĀČ¼×±½Ė®½āµĆ±½¼×Č©£¬±½¼×Č©ÓėHCN·¢Éś¼Ó³É·“Ӧɜ³É
£¬æÉŅŌÓĆ¼×±½ÓėĀČĘų·“Ӧɜ³É¶žĀČ¼×±½£¬¶žĀČ¼×±½Ė®½āµĆ±½¼×Č©£¬±½¼×Č©ÓėHCN·¢Éś¼Ó³É·“Ӧɜ³É £¬
£¬ ŌŁĖįŠŌĖ®½āµĆ
ŌŁĖįŠŌĖ®½āµĆ £¬
£¬ ·¢Éśõ„»Æ·“Ó¦µĆ
·¢Éśõ„»Æ·“Ó¦µĆ £¬¾Ż“Ė“šĢā£»
£¬¾Ż“Ė“šĢā£»
½ā“š ½ā£ŗÓɼױ½Óė¶ŌĻõ»ł±½¼×ĖįµÄ½į¹¹¼ņŹ½æÉÖŖ£¬¼×±½·¢Éś¼×»ł¶ŌĪ»µÄĻõ»Æ·“Ӧɜ³ÉI£¬ŌņIĪŖ £¬
£¬ ŹĒŌ×ÓĄūÓĆĀŹĪŖ100%µÄ×Ŗ»Æ£¬ĖłŅŌ¢ņĪŖCH2=CH2£¬øł¾Ż¢õŗĶ¶Ō°±»ł±½¼×ĖįµÄ½į¹¹æÉÖŖ£¬¢ōĪŖ£ØC2H5£©2NCH2CH2OH£¬»·ŃõŅŅĶéÓė¢ó·¢ÉśŠÅĻ¢¢ŁµÄ·“Ӧɜ³É¢ō£¬ĖłŅŌ¢óĪŖ£ØC2H5£©2NH£¬
ŹĒŌ×ÓĄūÓĆĀŹĪŖ100%µÄ×Ŗ»Æ£¬ĖłŅŌ¢ņĪŖCH2=CH2£¬øł¾Ż¢õŗĶ¶Ō°±»ł±½¼×ĖįµÄ½į¹¹æÉÖŖ£¬¢ōĪŖ£ØC2H5£©2NCH2CH2OH£¬»·ŃõŅŅĶéÓė¢ó·¢ÉśŠÅĻ¢¢ŁµÄ·“Ӧɜ³É¢ō£¬ĖłŅŌ¢óĪŖ£ØC2H5£©2NH£¬
£Ø1£©øł¾ŻÉĻĆęµÄ·ÖĪöæÉÖŖ£¬¢ņµÄ½į¹¹¼ņŹ½ĪŖ CH2=CH2£¬
¹Ź“š°øĪŖ£ŗCH2=CH2£»
£Ø2£©¢óµÄ½į¹¹¼ņŹ½ĪŖ £ØC2H5£©2NH£¬
¹Ź“š°øĪŖ£ŗ£ØC2H5£©2NH£»
£Ø3£©ÓŠ»śĪļ ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś¾ŪŗĻ·“Ӧɜ³É¾Ūõ£°·Ąąøß·Ö×Ó»ÆŗĻĪļ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ
ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś¾ŪŗĻ·“Ӧɜ³É¾Ūõ£°·Ąąøß·Ö×Ó»ÆŗĻĪļ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø4£©ŅŌ¼×±½ĪŖŌĮĻŗĻ³É £¬æÉŅŌÓĆ¼×±½ÓėĀČĘų·“Ӧɜ³É¶žĀČ¼×±½£¬¶žĀČ¼×±½Ė®½āµĆ±½¼×Č©£¬±½¼×Č©ÓėHCN·¢Éś¼Ó³É·“Ӧɜ³É
£¬æÉŅŌÓĆ¼×±½ÓėĀČĘų·“Ӧɜ³É¶žĀČ¼×±½£¬¶žĀČ¼×±½Ė®½āµĆ±½¼×Č©£¬±½¼×Č©ÓėHCN·¢Éś¼Ó³É·“Ӧɜ³É £¬
£¬ ŌŁĖįŠŌĖ®½āµĆ
ŌŁĖįŠŌĖ®½āµĆ £¬
£¬ ·¢Éśõ„»Æ·“Ó¦µĆ
·¢Éśõ„»Æ·“Ó¦µĆ £¬
£¬
£¬Ōņ·“Ó¦µÄĮ÷³ĢĶ¼ĪŖ $”ś_{¹āÕÕ}^{ĀČĘų}$
$”ś_{¹āÕÕ}^{ĀČĘų}$ $”ś_{”÷}^{ĒāŃõ»ÆÄĘČÜŅŗ}$
$”ś_{”÷}^{ĒāŃõ»ÆÄĘČÜŅŗ}$ $\stackrel{HCN}{”ś}$””
$\stackrel{HCN}{”ś}$”” $”ś_{H_{2}O}^{H+}$
$”ś_{H_{2}O}^{H+}$ $”ś_{”÷}^{ÅØH_{2}SO_{4}}$
$”ś_{”÷}^{ÅØH_{2}SO_{4}}$ £¬
£¬
¹Ź“š°øĪŖ£ŗ $”ś_{¹āÕÕ}^{ĀČĘų}$
$”ś_{¹āÕÕ}^{ĀČĘų}$ $”ś_{”÷}^{ĒāŃõ»ÆÄĘČÜŅŗ}$
$”ś_{”÷}^{ĒāŃõ»ÆÄĘČÜŅŗ}$ $\stackrel{HCN}{”ś}$””
$\stackrel{HCN}{”ś}$”” $”ś_{H_{2}O}^{H+}$
$”ś_{H_{2}O}^{H+}$ $”ś_{”÷}^{ÅØH_{2}SO_{4}}$
$”ś_{”÷}^{ÅØH_{2}SO_{4}}$ £®
£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļµÄĶʶĻÓėŗĻ³É£¬³ä·ÖĄūÓĆÓŠ»śĪļµÄ·Ö×ÓŹ½Óė½į¹¹·ÖĪö½ā“š£¬×¢Ņā¹ŁÄÜĶŵÄŅżČė”¢Ļū³żÓėŃܱ䣬ŠčŅŖѧɜŹģĮ·ÕĘĪÕ¹ŁÄÜĶŵĊŌÖŹÓė×Ŗ»Æ£¬ÄѶČÖŠµČ£®


 ÖĒȤŗ®¼Ł×÷ŅµŌĘÄĻæĘ¼¼³ö°ęÉēĻµĮŠ“š°ø
ÖĒȤŗ®¼Ł×÷ŅµŌĘÄĻæĘ¼¼³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚŅĀ¼ÜŗĶµēĻßĶāĆę°üÉĻŅ»²ćĖÜĮĻ²ć | B£® | ŌŚ“¬ÉķĻĀ·½Į¬½ÓĶæé | ||
| C£® | ½”ÉķĘ÷²Ä±ķĆęĖ¢ÓĶĘį | D£® | ŌŚøÖÖĘĘ·Ķā²ć¶ĘÉĻøõ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ōö¼ÓFeµÄĮæ£¬Õż·“Ó¦ĖŁĀŹŌö“ó | |
| B£® | ½«ČŻĘ÷µÄĢå»żĖõŠ”Ņ»°ė£¬ÕżÄę·“Ó¦ĖŁĀŹŌö“ó | |
| C£® | ±£³ÖĢå»ż²»±ä£¬³äČėNe£¬ÕżÄę·“Ó¦ĖŁĀŹŌö“ó | |
| D£® | ±£³ÖŃ¹Ēæ²»±ä£¬³äČėNe£¬ÕżÄę·“Ó¦ĖŁĀŹ²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬5.6 L H2Oŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.25NA | |
| B£® | ±ź×¼×“æöĻĀ£¬22.4 L H2ŗĶCl2µÄ»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ2NA | |
| C£® | ±ź×¼×“æöĻĀ£¬22.4 L SO3ŗ¬ÓŠµÄŌ×ÓøöŹżĪŖ3NA | |
| D£® | ³£ĪĀ³£Ń¹ĻĀ£¬58.5 g NaClÖŠŗ¬ÓŠµÄNa+Ąė×ÓŹżĪŖNA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| Ń”Ļī | ²»“æĪļÖŹ£ØŌÓÖŹ£© | ³żŌÓŹŌ¼Į»ņ·ÖĄė·½·Ø | ±ŲÓĆŅĒĘ÷ |
| A | µāĖ® | ĖÄĀČ»ÆĢ¼ ŻĶČ” | ·ÖŅŗĀ©¶· |
| B | Ņ»Ńõ»ÆĢ¼£Ø¶žŃõ»ÆĢ¼£© | ³ĪĒåŹÆ»ŅĖ® Ļ“Ęų | Ļ“ĘųĘæ |
| C | ĻõĖį¼Ų£ØĀČ»ÆÄĘ£© | Ö±½ÓÕō·¢½į¾§ | Õō·¢Ćó |
| D | ŅŅ“¼£ØĖ®£© | ÉśŹÆ»Ņ ÕōĮó | ÕōĮóÉÕĘæ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C2H5OH£Øl£©+3O2£Øg£©ØT2CO2 £Øg£©+3H2O£Øg£©”÷H=-1367.0 kJ/mol£ØČ¼ÉÕČČ£© | |
| B£® | NaOH£Øaq£©+HCl £Øaq£©ØTNaCl £Øaq£©+H2O£Øl£©”÷H=+57.3 kJ/mol£ØÖŠŗĶČČ£© | |
| C£® | S£Øs£©+O2£Øg£©ØTSO2£Øg£©”÷H=-269.8 kJ/mol£Ø·“Ó¦ČČ£© | |
| D£® | Fe+SØTFeS”÷H=-95.6 kJ/mol£Ø·“Ó¦ČČ£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ź±¼ä/h ĪļÖŹµÄĮæ/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com