
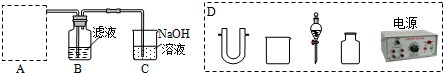
分析 (1)灼烧固体应选择坩埚来加热灼烧,温度升高物质溶解度增大,热水能加快物质溶解的速度;
(2)氯气制备一是在强酸性条件下用氧化剂氧化Cl-,实现该反应是常温下发生的氧化还原反应,据此选择实现此条件下的反应,二是电解法.限用图D中的仪器是电解饱和食盐水得到氯气,原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液,过量的氯气不能直接排放到空气中,用装置C中氢氧化钠溶液吸收避免污染;
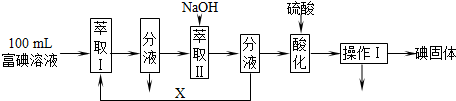
(3)萃取是一种常用的分离液-液混合物的方法,它是利用溶质在互不相溶的溶剂里溶解度的不同(溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度),用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作,分液是把互不相溶的两种液体分开的操作,一般分液都是与萃取配合使用的;取100mL B中富碘溶液,加入萃取剂X分液得到含碘单质的有机萃取剂,分液后加入氢氧化钠溶液发生反应3I2+6OH-→5I-+IO3-+3H2O,分液得到有机萃取剂重新利用,吸收碘单质的氢氧化钠溶液中加入硫酸酸化,发生反应5I-+IO3-+6H+→3I2+3H2O,操作Ⅰ后得到碘单质固体,说明操作Ⅰ为过滤;
(4)氯化钾样品中含K2CO3,测定K2CO3的质量分数,需要加入试剂沉淀碳酸根离子且不引入新的杂质,测定样品质量和生成沉淀质量,依据元素守恒计算碳酸钾的质量分数;
解答 解:(1)灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在坩埚中加热,选用热水而不是冷水浸泡海带灰的目的是加快溶解速率,
故答案为:坩埚,加快溶解速率;
(2)氯气制备方法:一是在强酸性条件下用氧化剂氧化Cl-,实现该反应是常温下发生的氧化还原反应,据此选择实现此条件下的反应,二是电解法.限用图D中的仪器是电解饱和食盐水得到氯气,
a.2NaCl(s)+MnO2+2H2SO4(浓)$\stackrel{△}{→}$MnSO4+Cl2↑+Na2SO4+2H2O,反应需要加热,故a错误;
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O,此反应不需要加热常温下发生反应生成氯气,故b正确;
c.2NaCl+2H2O$\stackrel{通电}{→}$2NaOH+Cl2↑+H2↑,反应是通电电解氯化钠溶液,是工业氯碱工业原理,故C正确;
d.4HCl(浓)+MnO2$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O,反应需要加热反应,故d错误;
原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液,广口瓶B中是发生反应的离子方程式是 Cl2+2I-=I2+2Cl-,过量的氯气不能直接排放到空气中,用装置C中氢氧化钠溶液吸收,避免污染,
故答案为:bc,Cl2+2I-=I2+2Cl-,吸收未反应的氯气,防止污染;
(3)萃取剂X应选择不溶于水的有机溶剂且碘单质在其中溶解性大,
a.苯不溶于水,碘单质在苯中溶解性大,但100mL苯的体积和溶液体积相同,萃取碘单质后浓度小,试剂浪费,故a错误;
b.10mL乙醇和水溶液混溶,不能分层,不能做萃取剂,故b错误;
c.10mLCCl4 和水溶液不溶,能分层且碘单质在其中溶解性大,可以做萃取剂,故c正确;
d.10mL己烯和碘单质发生加成反应,不能做萃取剂,故d错误;
故选c,
取100mL B中富碘溶液,加入萃取剂X分液得到含碘单质的有机萃取剂,依据萃取原理可知,萃取剂X应选择不溶于水的有机溶剂且碘单质在其中溶解性大,萃取分液需要的仪器是分液漏斗,烧杯,分液后加入氢氧化钠溶液发生反应3I2+6OH-→5I-+IO3-+3H2O,分液得到有机萃取剂重新利用,吸收碘单质的氢氧化钠溶液中加入硫酸酸化,发生反应5I-+IO3-+6H+→3I2+3H2O,操作Ⅰ后得到碘单质固体,说明操作Ⅰ为过滤;
故答案为:c,分液漏斗,过滤;
(4)用沉淀法测定氯化钾样品中K2CO3的质量分数,称量一定质量的样品,在烧杯中溶解,加入过量BaCl2或CaCl2溶液,沉淀碳酸根离子生成沉淀,过滤得到沉淀,洗涤、干燥,称量沉淀质量,计算沉淀物质的量,结合碳元素守恒,计算碳酸钾质量,进而得到碳酸钾的质量分数,
①要用到的化学试剂是BaCl2或CaCl2,
故答案为:BaCl2或CaCl2;
②要测定的物理量是需要测定样品质量和干燥沉淀质量,
故答案为:样品质量和干燥沉淀质量;
点评 本题考查了海水资源的应用,实验基本操作,氯气制备方法和装置选择,物质的提纯分离试验过程设计,注意萃取分液实验原理和操作的理解应用,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何气体单质在标准状况下体积约为22.4L,则含有2NA个原子 | |
| B. | 常温常压下,16g氧气和32 g臭氧(O3)所含氧原子总数为3NA | |
| C. | 常温常压下,11.2L甲烷中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3mol二氧化碳中含有氧原子数0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 用硫酸铜溶液吸收硫化氢气体:Cu2++S2-═CuS↓ | |
| C. | 稀硝酸中加入过量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| D. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++HCO3-+OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +RX$\stackrel{催化剂}{→}$
+RX$\stackrel{催化剂}{→}$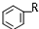 +HX完成下列填空:
+HX完成下列填空: 2HCHO+2H2O.
2HCHO+2H2O.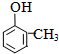 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活动性:Cl->Br->I- | B. | 还原性:I->Br->Cl- | ||
| C. | 稳定性:AgCl>AgBr>AgI | D. | Ksp:AgCl>AgBr>AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中放入NaCl溶液,加热NaCl溶液制取NaCl晶体 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用酒精萃取溴水中的溴单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶液 | B. | AgNO3溶液 | C. | Ba(OH)2溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 碱性:Na2CO3<NaHCO3 | ||
| C. | 水中的溶解度:Na2CO3<NaHCO3 | D. | 与盐酸反应速度Na2CO3>NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com