
| A. | 用湿润的pH试纸测定某稀醋酸溶液的pH | |
| B. | 做完银镜反应的试管可以用氨水来洗涤 | |
| C. | 为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离 | |
| D. | 如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
分析 A.pH试纸不能事先湿润;
B.Ag与氨水不反应;
C.苯是一种良好的有机溶剂,溴、苯酚以及三溴苯酚都能溶于苯中;
D.苯酚有毒,可使蛋白质发生变性,苯酚易溶于酒精.
解答 解:A.pH试纸不能事先湿润,否则导致溶液浓度偏低,故A错误;
B.Ag与氨水不反应,则不能利用氨水洗涤,应做完银镜反应的试管用硝酸来洗涤,故B错误;
C.加浓溴水,生成三溴苯酚,三溴苯酚和溴都能与苯互溶,不能将二者分离,并引入新的杂质,故C错误;
D.苯酚有毒,可使蛋白质发生变性,苯酚易溶于酒精,则苯酚浓溶液沾到皮肤上,应立即用酒精擦洗,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及pH的测定、仪器的洗涤、混合物分离提纯及实验安全等,侧重物质性质及实验技能的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.11mol | B. | 0.22mol | C. | 0.16mol | D. | 0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸和醋酸分别与锌反应放出的氢气一样多 | |
| C. | 醋酸与锌反应所需时间长 | |
| D. | 盐酸和醋酸分别与锌反应所需时间一样长 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
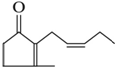 有机化合物A是人工合成的香料茉莉酮,其结构简式如图:
有机化合物A是人工合成的香料茉莉酮,其结构简式如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
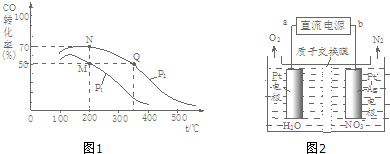
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
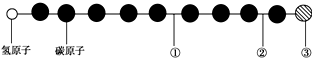
| A. | ①处的化学键是碳碳双键 | B. | ②处的化学键是碳碳三键 | ||
| C. | ③处的原子可能是氯原子或氟原子 | D. | ②处的化学键是碳碳单键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com