
【题目】现有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl﹣)为1.3mol/L,要使Mg2+与Al3+完全分离,至少需加4mol/L的NaOH溶液的体积为( )
A.40mL
B.72mL
C.80mL
D.128mL
【答案】C
【解析】解:MgCl2和AlCl3的混合溶液,其中Mg2+浓度为0.2molL﹣1 , Cl﹣浓度为1.3molL﹣1 ,
设Al3+的浓度为x,由电荷守恒可知,
0.2mol/L×2+x×3=1.3mol/L×1,
解得x=0.3mol/L,
则将Mg2+、Al3+的物质的量分别为0.2L×0.2mol/L=0.04mol、0.2L×0.3mol/L=0.06mol,
由发生反应为
MgCl2 | + | 2NaOH | = | Mg(OH)2↓ | + | 2NaCl |
1 | 2 | |||||
0.04mol | 0.08mol |
AlCl3 | + | 4NaOH | = | NaAlO2 | + | 3NaCl | + | 2H2O |
1 | 4 | |||||||
0.06mol | 0.24mol |
使Mg2+全部转化为沉淀分离出来,消耗的NaOH的物质的量为0.08mol+0.24mol=0.32mol,
则需加4molL﹣1NaOH溶液的体积为 ![]() =0.08L=80mL,
=0.08L=80mL,
故选C.


科目:高中化学 来源: 题型:
【题目】一定温度下,将4molPCl3和2molCl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2PCl5 , 各物质均为气态.达平衡后,PCl5为0.8mol.若此时再移走2molPCl3和1molCl2 , 相同温度下达到平衡,PCl5的物质的量为( )
A.0.8mol
B.0.4mol
C.0.4mol<x<0.8mol
D.<0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.乙醇和乙酸都存在碳氧双键
B.甲烷和乙烯都可以与氯气反应
C.酸性高锰酸钾可以氧化苯和乙醛
D.乙烯可以与氢气发生加成反应,而苯不能与氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.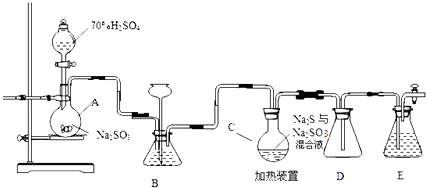
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)装置A中发生的化学反应方程式为
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 .
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 .
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是 , 装置E的作用为
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质.利用所给试剂设计实验,检测产品中是否存在Na2SO4 , 简要说明实验操作,现象和结论: . 已知:Na2S2O35H2O遇酸易分解:S2O32+2H+=S↓+SO2↑+H2O供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种食用精制盐包装袋上有如表说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)KIO3+KI+H2SO4═K2SO4+I2+H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是 .
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 , 上述操作正确的顺序是:(填序号)
(3)已知:I2+2S2O32﹣═2I﹣+S4O62﹣ . 某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10﹣3molL﹣1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是 .
②b中反应所产生的I2的物质的量是mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的s能级电子总数与p能级电子总数相等,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)E+离子的基态核外电子排布
(2)B、C、D中第一电离能由大到小的顺序为(填元素符号)
(3)A和B、C两元素形成的两种共价化合物发生反应,生成BA4+离子,该离子的中心原子的杂化方式为;与BA4+离子互为等电子体的一种分子为(填化学式).
(4)E的硫酸盐溶液中滴加过量的氨水可以生成配合物[E(NH3)4]SO4 , 1mol配合物中含有的σ键的数目为 .
(5)E和C(空心小球为C,实心小球为E)形成的一种离子化合物的晶体结构如图所示,则离子化合物的化学式为 . 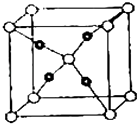
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.0.5mol雄黄(As4S4 , 结构如图)含有NA个S﹣S键 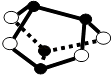
B.1mol/L(NH4)2SO4溶液中,含SO42﹣NA个,NH4+少于2NA个
C.23g钠与一定量的氧气作用,若两者均无剩余,转移NA个电子
D.将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1 NA个Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 二氧化硅溶于水显酸性B. 二氧化硅是酸性氧化物,它不溶于任何酸
C. 二氧化硅和硅都是半导体材料D. 工业上以二氧化硅为原料生产硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com