
| A.氟化氢 | B.水 | C.硅化氢 | D.二氧化碳 |
科目:高中化学 来源:不详 题型:单选题
| A.IA族 | B.ⅡA族 | C.ⅢA族 | D.IVA族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素原子的最外层电予数等于元素的最高化合价 |
| B.电子层数相同的主族元素,最外层电子数多的原子半径小 |
| C.K、Mg、Al失电子能力和最高价氧化物水化物的碱性均依次增强 |
D.第三周期元素中,最外层电子数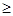 电子层数的为非金属元素 电子层数的为非金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。
。 子方程式_______________________________,______________________。
子方程式_______________________________,______________________。 ________________。用电子式表示BeCl2的形成过程____________________________________________
________________。用电子式表示BeCl2的形成过程____________________________________________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.具有相同质子数的粒子都具有相同的性质 |
| B.含金属元素的离子不一定是阳离子 |
| C.由不同原子组成的物质肯定不是单质 |
| D.一种元素可形成多种离子,但只能是带同种电荷的离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 _____,A与B结合形成化合物的化学式为_______________。
_____,A与B结合形成化合物的化学式为_______________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
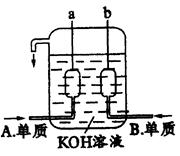
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com