
| A. | HCO3-、Al3+、Na+、SO42- | B. | I-、NO3-、K+、NH4+ | ||
| C. | MnO4-、Cl-、SO42-、K+ | D. | SiO32-、SO32-、Na+、Cl- |
分析 由水电离出来的H+和OH-浓度的乘积为10-24,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、相互促进水解等,则离子大量共存,并结合离子的颜色来解答.
解答 解:室温下,某无色溶液中由水电离出来的H+和OH-浓度的乘积为10-24,为酸或碱溶液;
B.酸碱溶液均不能大量存在HCO3-,且HCO3-、Al3+相互促进水解不能共存,故A不选;
B.酸溶液中I-、NO3-发生氧化还原反应,碱溶液中不能大量存在NH4+,故B不选;
C.MnO4-为紫色,与无色不符,且酸溶液中MnO4-、Cl-发生氧化还原反应,不能共存,故C不选;
D.碱溶液中该组离子之间不反应,可大量共存,且离子均为无色,故D选;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、复分解反应的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 催化剂是影响化学反应速率的主要因素 | |
| B. | 化学反应的反应热与反应途径无关 | |
| C. | 增大压强一定能增大化学反应速率 | |
| D. | 反应物分子间发生碰撞即可发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3可用作耐火材料,用小苏打发酵面团制作馒头 | |
| B. | 碳素钢的熔点比纯铁低、司母戊鼎的主要成分是铜合金 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ•mol-1(燃烧热) | |
| B. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 已知:2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2有漂白性,因而SO2可使溴水褪色 | |
| B. | Cl2有漂白性,因而Cl2能使品红溶液褪色 | |
| C. | 浓硫酸有吸水性,因而浓硫酸可用于干燥H2和CO | |
| D. | Fe3+有强氧化性,因而FeCl3溶液可用于回收废旧电路板中的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Fe2+、NO3-、SO42- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为2Al2O3(s)+6Cl2(g)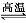 4AlCl3(g)+3O2(g) ΔH>0。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0。下列分析错误的是( )
A.增大反应体系的压强,反应速率增大
B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量
C.电解熔融的Al2O3和AlCl3均能得到单质铝
D.升高温度,反应的平衡常数将增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:填空题
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示, K值大小与温度的关系是:温度升高,K值 。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
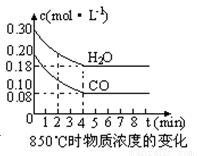
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c 1数值 0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 (单选),表中5min~6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com