
(12分)化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列ΔH表示物质燃烧热的是 ;表示物质中和热的是 。
(填“ΔH1”、“ΔH2”和“ΔH3”等)
A.2H2(g)+O2(g) = 2H2O(l) ΔH1
B.C(s)+1/2O2(g) = CO(g) ΔH2
C.CH4(g)+2O2(g) = CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)= CO2(g) ΔH4
E.C6H12O6(s)+6O2(g) = 6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l) ΔH7
(2)已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是 。
A.C2H6(g)+7/2O2(g) = 2CO2(g)+3H2O(l) ΔH= +2akJ/mol
B.C2H6(g)+7/2O2(g) = 2CO2(g)+3H2O(g) ΔH= -2akJ/mol
C.2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) ΔH= -4akJ/mol
D.2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(g) ΔH= -4akJ/mol
(3)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),下表是部分化学键的键能数据: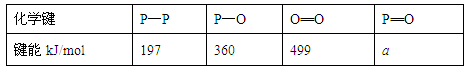
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如下图所示,则上表中a= 。
(4)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为 。
(1)ΔH4、ΔH5(2分) ΔH6(2分)
(2)C (2分)
(3) 433.75(3分)
(4)CH3OH(l)+O2(g) = CO2(g)+2H2O(l) ΔH= -725.76kJ/mol(3分)
解析试题分析:(1)燃烧热强调1mol纯物质完全燃烧生成稳定的化合物放出的热量,故ΔH4、ΔH5符合。中和热强调酸碱反应生成1mol水放出的热量,故ΔH6符合;
(2)15g乙烷即0.5mol燃烧放出akJ的热量,则1mol乙烷燃烧放出2aKJ热量,2mol乙烷燃烧放出4aKJ热量,生成液体水,且ΔH<0,故只有C符合,选C;
(3)1mol白磷(P4)的燃烧为P4(s)+5O2(g) = P4O10(s)ΔH=-2378.0kJ/mol,需断 6molP—P和5molO=O,形成12molP—O和4molP=O,所以(4a+12·360 kJ/mol )-(6·197+5·499 kJ/mol )="2378" kJ/mol ,解得a="433.75" kJ/mol;
(4)1g甲醇燃烧生成CO2和液态水时放热22.68kJ ,则32g即1mol甲醇燃烧放出热量为725.76kJ/mol ,且ΔH<0,故甲醇的燃烧热方程为:CH3OH(l)+O2(g) = CO2(g)+2H2O(l) ΔH= -725.76kJ/mol。
考点:燃烧热;中和热
点评:本题考查化学反应热中燃烧热和中和热的知识,题目较为基础,可根据所学知识进行解答。


科目:高中化学 来源: 题型:
(4分)室温下,将铁片、铜片、铝片(表面用砂纸打磨过)分别投入浓盐酸、浓硫酸、浓硝酸、浓氢氧化钠溶液四种试剂中,做了12个实验,实验的编号如下表所示。
|
| 浓盐酸 | 浓硫酸 | 浓硝酸 | 浓氢氧化钠溶液 |
| 铝 | 实验1 | 实验2 | 实验3 | 实验4 |
| 铁 | 实验5 | 实验6 | 实验7 | 实验8 |
| 铜 | 实验9 | 实验1O | 实验11 | 实验12 |
回答有关上述实验的下列问题:
(1) 若给以上溶液加热,也不会发生化学反应的实验是 和12(填实验编号)。
(2) 写出实验4发生的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三12月月考化学试卷(解析版) 题型:计算题
(15分)淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;②将一定量的淀粉水解液加入三颈烧瓶中;③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3、98%H2SO4的质量比为2:1.5)溶液;④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
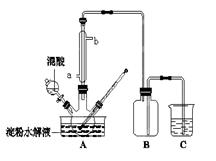
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O 3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水的进口是 (填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其
原因是 。
(3)检验淀粉是否水解完全所用的试剂为 。
(4)草酸重结晶的减压过滤操作中,除烧杯,玻璃棒外,还必须使用属于硅酸盐材料的仪器有
(5)当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应方程式为: 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。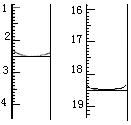
查看答案和解析>>
科目:高中化学 来源:2013届广东省高一下学期第一次月考化学试卷 题型:填空题
(4分)室温下,将铁片、铜片、铝片(表面用砂纸打磨过)分别投入浓盐酸、浓硫酸、浓硝酸、浓氢氧化钠溶液四种试剂中,做了12个实验,实验的编号如下表所示。
|
|
浓盐酸 |
浓硫酸 |
浓硝酸 |
浓氢氧化钠溶液 |
|
铝 |
实验1 |
实验2 |
实验3 |
实验4 |
|
铁 |
实验5 |
实验6 |
实验7 |
实验8 |
|
铜 |
实验9 |
实验1O |
实验11 |
实验12 |
回答有关上述实验的下列问题:
(1) 若给以上溶液加热,也不会发生化学反应的实验是 和12(填实验编号)。
(2) 写出实验4发生的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:09-10学年抚顺一中高一下学期5月理综化学部分 题型:实验题
(14分)该图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。(已知一氯乙烷沸点:12.3℃)试回答:
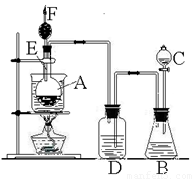
(1)B逸出的主要气体名称__________;
(2)D瓶的作用是___________________;
(3)E管的作用是_____________________;
(4)F管口点燃的气体分子式__________________
(5)A瓶中无水硫酸铜粉末变蓝的原因是______________________________;
(6)A中发生反应的化学方程式:________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分) Fridel―Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下: ![]() ;△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇与盐酸反应制得叔丁基氯(沸点50.7℃),再利用Fridel―Crafts反应原理制备对叔丁基苯酚(熔点99℃)。反应流程及实验装置如下图所示:
;△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇与盐酸反应制得叔丁基氯(沸点50.7℃),再利用Fridel―Crafts反应原理制备对叔丁基苯酚(熔点99℃)。反应流程及实验装置如下图所示:

试回答下列问题:
(1)请写出本实验过程中的两个主要化学反应方程式: , 。
(2)有机层中加入饱和食盐水及饱和碳酸氢钠的作用可能是: 。
通过 操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯。
(3)若去掉该制备装置中的氯化钙干燥管,有可能导致的不良后果是(用化学方程式并配合文字说明): 。
(4)叔丁基氯与苯酚反应时适当控制温度是很重要的。若反应过程中温度过高应用冷水浴冷却,否则可能导致的不良后果是: 。
(5)常温下叔丁基氯易于发生消去反应故实验中所用的必须现用现配,试写出叔丁基氯发生消去反应反应的化学方程式: 。
(6)有时候最终产品对叔丁基苯酚不是白色而呈现紫色,你认为可能的原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com