
| 混合物 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 液态氯气 | 苛性钠 | 硫酸铜 | 氧化铁 | 二氧化碳 |
| B | 氯水 | 烧碱 | 食盐 | 氧化钠 | 氧化铝 |
| C | 84消毒液 | 纯碱 | 石灰石 | 氨气 | 水 |
| D | 漂白粉 | 熟石灰 | 苏打 | 生石灰 | 二氧化硫 |
| A、A | B、B | C、C | D、D |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、加压 | B、减压 |
| C、降温 | D、充入氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
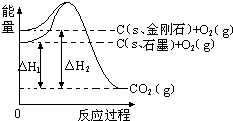
| A、1mol石墨的总键能比1mol金刚石的总键能小1.9kJ |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、C(s、石墨)═C(s、金刚石)△H=+1.9kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Fe3+、I-、SO42- |
| B、Al3+、Mg2+、HCO3-、Cl- |
| C、K+、Ag+、Ca2+、PO43- |
| D、NH4+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15mL | B、25mL |
| C、35mL | D、50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/L |
| B、0.1mol/L |
| C、0.05mol/L |
| D、0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
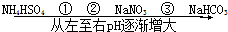 在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示.图中①、②、③可能是( )
在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示.图中①、②、③可能是( )| A、NH4NO3、(NH4)2SO4、CH3COONa |
| B、(NH4)2SO4、NH4Cl、C6H5ONa |
| C、(NH4)2SO4、NH4NO3、Na2CO3 |
| D、(NH4)2SO4、NH4NO3、CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:
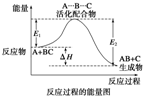
A、反应过程可表示为
| ||||||
| B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | ||||||
| C、正反应的热效应为△H=E1-E2<0,所以正反应为放热反应 | ||||||
| D、此图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com