
| A. | 乙烯和聚乙烯都能使溴水褪色 | |
| B. | 用新制的氢氧化铜浊液不能检验淀粉和纤维素是否发生了水解 | |
| C. | 油脂的水解反应,都是皂化反应 | |
| D. | 橄榄油、茶籽油和花生油等都能使溴水褪色 |
分析 A.聚乙烯中不含碳碳双键;
B.水解后在碱性条件下加新制的氢氧化铜浊液检验葡萄糖;
C.油脂在碱性条件下水解为皂化反应;
D.橄榄油、茶籽油和花生油均为油,含碳碳双键.
解答 解:A.聚乙烯中不含碳碳双键,则乙烯能使溴水褪色,而聚乙烯不能,故A错误;
B.水解后在碱性条件下加新制的氢氧化铜浊液检验葡萄糖,则用新制的氢氧化铜浊液能检验淀粉和纤维素是否发生了水解,故B错误;
C.油脂在碱性条件下水解为皂化反应,而酸性条件下水解不是皂化反应,故C错误;
D.橄榄油、茶籽油和花生油均为油,含碳碳双键,则都能使溴水褪色,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团及性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该反应中的氧化剂是Cu2O | |
| B. | 氧化产物和还原产物的物质的量之比为1:6 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | Cu2S在反应中仅做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA | |
| D. | 常温常压下,11.2L甲烷含有共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
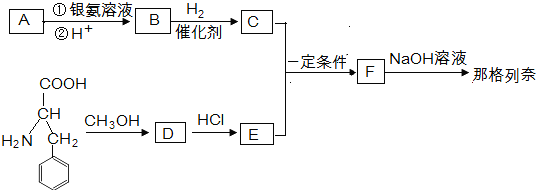
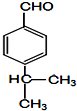
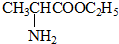 +HCl→
+HCl→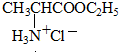
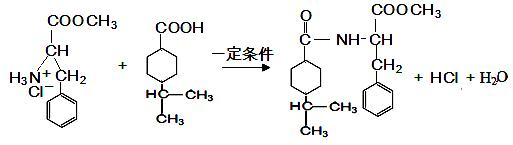
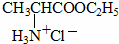 $→_{一定条件}^{CH_{3}COOH}$
$→_{一定条件}^{CH_{3}COOH}$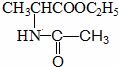
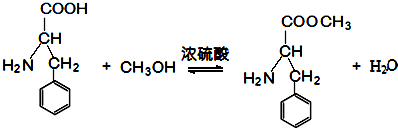
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
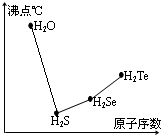 氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.
氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.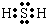 .在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.
.在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 埋在地下的钢管与电源负极连接可以减缓腐蚀 | |
| B. | 原电池负极和电解池阳极发生的都是氧化反应 | |
| C. | 钢铁析氢腐蚀的正极反应:2H++2e→H2↑ | |
| D. | 为了避免青铜器生成铜绿,将青铜器放在银质托盘上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
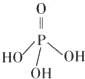 磷元素的单质及其化合物在生产和生活中有着广泛的应用.
磷元素的单质及其化合物在生产和生活中有着广泛的应用.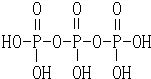 .
.| 电离常数(25℃) |
| HF:Ki=3.6×10 -4 |
| H3PO4:Ki1=7.5×10 -3, Ki2=6.2×10 -8,Ki3=2.2×10 -13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| B. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| C. | 一定条件下,氨基酸之间能发生反应,合成更复杂的化合物(多肽) | |
| D. | 向2ml苯中加入1ml酸性高锰酸钾溶液,振荡后静置,可观察到液体分层,上层呈紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com