
ŹµŃéŹŅÖŠŠčŅŖÅäÖĘ500mL 0.10 mol”¤L-1µÄNaOHČÜŅŗ£¬¾ĶøĆŹµŃé»Ų“šĻĀĮŠĪŹĢā”£
£Ø1£©ÓĆĶŠÅĢĢģĘ½³ĘĮæNaOH¹ĢĢå g”£
³ĘĮæNaOH¹ĢĢåŠč×¢ŅāŅŌĻĀĮ½øöĪŹĢā£ŗ¢ŁŅņĪŖNaOH¾ßÓŠøÆŹ“ŠŌ£¬ĖłŅŌ³ĘĮæŹ±£¬Šč×¢ŅāŃ”Ōń Ź¢×°NaOH¹ĢĢ壻¢Ś³ĘĮæ±ŲŠėŃøĖŁ£¬ÄæµÄŹĒ ”£
£Ø2£©ŹµŃéĖłŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠ ”£
£Ø3£©ĻĀĮŠ²Ł×÷¶ŌĖłÅäÖʵÄČÜŅŗÅضČƻӊӰĻģµÄŹĒ ”£
A£®³ĘĮæŹ±ŅŃ¹Ū²ģµ½NaOHĪüĖ®
B£®½«ÉÕ±ÖŠČܽāŗóµÄČÜŅŗ×¢ČėČŻĮæĘ棬Į¢¼“Ģķ¼ÓÕōĮóĖ®ÖĮæĢ¶ČĻß
C£®¶ØČŻ”¢Ņ”ŌČŗó£¬ÓĆ½ŗĶ·µĪ¹ÜĻņČŻĮæĘæÖŠµĪ¼ÓÕōĮóĖ®ÖĮæĢ¶ČĻß
D£®ÅäÖĘČÜŅŗĒ°ÓĆÕōĮóĖ®ČóĻ“ČŻĮæĘæ
 ĢōÕ½100µ„ŌŖ¼ģ²āŹŌ¾ķĻµĮŠ“š°ø
ĢōÕ½100µ„ŌŖ¼ģ²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğŗžÄĻ³£µĀŹÆĆŵŚŅ»ÖŠŃ§ø߶žÉĻĘŚÖŠĄķ»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®ŹŅĪĀĻĀ£¬½«pH£½3µÄ“×ĖįČÜŅŗĻ”ŹĶµ½ŌĢå»żµÄ10±¶ŗó£¬ČÜŅŗµÄpH£½4
B£®ĻąĶ¬ĪĀ¶ČĻĀ£¬½«×ćĮæĀČ»ÆŅų¹ĢĢå·Ö±š¼ÓČė£ŗ¢Ł ÕōĮóĖ®”¢ ¢Ś 0.1 mol”¤L£1ĀČ»ÆĆ¾ČÜŅŗ”¢¢Ū 0.1 mol”¤L£1ŃĪĖį”¢¢Ü 0.1 mol”¤L£1ĻõĖįŅųČÜŅŗÖŠ£¬³ä·ÖČܽāŗóAg£«ÅØ¶Č£ŗ¢Ł£¾ ¢Ū£½¢Ü£¾¢Ś
C£®ŹŅĪĀĻĀ£¬pH£½3µÄCH3COOHČÜŅŗÓėpH£½11µÄNaOHČÜŅŗµČĢå»ż»ģŗĻŗóČÜŅŗµÄpH£¼7
D£®ĪŖČ·¶ØijĖįH2AŹĒĒæĖį»¹ŹĒČõĖį£¬æɲā¶ØŹŅĪĀŹ±NaHAČÜŅŗµÄpH”£ČōpH>7£¬ŌņH2AŹĒČõĖį£»ČōpH<7£¬ŌņH2AŹĒĒæĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģÕć½Ź”¼ĪŠĖ”¢ŗ¼ÖŻ”¢Äž²ØĪ劣øßČżÉĻµŚŅ»“ĪĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠŅĄ¾ŻČČ»Æѧ·½³ĢŹ½µĆ³öµÄ½įĀŪÕżČ·µÄŹĒ
A£®Čō2H2(g)+O2(g) =2H2O(g)¦¤H=-483.6 kJ”¤mol£1£¬ŌņH2µÄ±ź×¼Č¼ÉÕČČĪŖ-241.8 kJ”¤mol£1
B£®ČōC(ŹÆÄ«£¬s) =C(½šøÕŹÆ£¬s) ¦¤H>0£¬ŌņŹÆÄ«±Č½šøÕŹÆĪȶØ
C£®ŅŃÖŖNaOH(aq)£«HCl(aq)=NaCl(aq)£«H2O(l) ¦¤H£½-57.4 kJ”¤mol-1£¬Ōņ20.0g NaOH¹ĢĢåÓėĻ”ŃĪĖįĶźČ«ÖŠŗĶ£¬·Å³ö28.7 kJµÄČČĮæ
D£®ŅŃÖŖ2C(s)£«2O2(g) =2CO2(g) ¦¤H1£»2C(s)£«O2(g) =2CO(g) ¦¤H2£¬Ōņ¦¤H1>¦¤H2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ¹ć¶«ÉīŪŚøß¼¶ÖŠŃ§øßŅ»ÉĻĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ĀČ»ÆÄĘŹĒČÕ³£Éś»īµÄ±ŲŠčĘ·£¬Ņ²ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ”£“ÖŃĪ³żŗ¬NaClĶā£¬»¹ŗ¬ÓŠÉŁĮæMgCl2”¢CaCl2”¢Na2SO4ŅŌ¼°ÄąÉ³µČŌÓÖŹ”£ŅŌĻĀŹĒ“ÖŃĪĢį“æµÄ²Ł×÷Į÷³Ģ”£
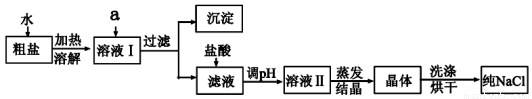
ĻŽŃ”ŹŌ¼Į£ŗNa2CO3ČÜŅŗ”¢K2CO3ČÜŅŗ”¢NaOHČÜŅŗ”¢BaCl2ČÜŅŗ”¢Ba(NO3)2ČÜŅŗ”¢±„ŗĶNaClČÜŅŗ”£
£Ø1£©Óū³żČ„ČÜŅŗIÖŠµÄMgCl2”¢CaCl2”¢Na2SO4£¬“ÓĢį¹©µÄŹŌ¼ĮÖŠŃ”³öaĖł“ś±ķµÄŹŌ¼Į£¬°“µĪ¼ÓĖ³ŠņŅĄ“ĪĪŖ£ŗ¹żĮæµÄNaOHČÜŅŗ”¢_________”¢________£»Éś ³ÉµÄ³Įµķŗ¬ÓŠµÄ³É·ÖĪŖÄąÉ³”¢________”£
³ÉµÄ³Įµķŗ¬ÓŠµÄ³É·ÖĪŖÄąÉ³”¢________”£
£Ø2£©ŌŚĀĖŅŗÖŠ¼ÓŃĪĖį·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ____________________________________£»
£Ø3£©¶ŌČÜŅŗII“¦ĄķµĆµ½¾§ĢåŹ±£¬Ėł±ŲŠėŹ¹ÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠ_________ÖÖ”£
£Ø4£©µĆµ½µÄNaCl“æĘ·¾²ā¶Ø·¢ĻÖĘäŗ¬ÓŠµÄNaClÓė“ÖŃĪÖŠNaClµÄÖŹĮæŅ»ÖĀ£¬Ä³Ķ¬Ń§ČĻĪŖ“Ė“ĪŹµŃé·Ē³£³É¹¦Ć»ÓŠĪó²ī£¬ÄćŹĒ·ńĶ¬ŅāĖūµÄ¹Ūµć£æ_______£ØĢī”°ŹĒ”±»ņ”°·ń”±£©£¬²¢øų³öÄćµÄĄķÓÉ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ¹ć¶«ÉīŪŚøß¼¶ÖŠŃ§ø߶žÉĻĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ijĪĀ¶ČĻĀ£¬Fe£ØOH£©3£Øs£©”¢Cu£ØOH£©2£Øs£©·Ö±šŌŚČÜŅŗÖŠ“ļµ½³ĮµķČܽāĘ½ŗāŗó£¬øıäČÜŅŗpH£¬½šŹōŃōĄė×ÓÅØ¶ČµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£¾ŻĶ¼·ÖĪö£¬ĻĀĮŠÅŠ¶Ļ²»ÕżČ·µÄŹĒ
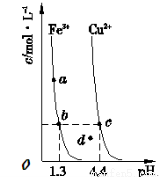
A£®Ksp£ŪFe£ØOH£©3£Ż<Ksp£ŪCu£ØOH£©2 £Ż
B£®¼ÓŹŹĮæNH4 Cl¹ĢĢåæÉŹ¹ČÜŅŗÓÉaµć±äµ½bµć
C£®c”¢dĮ½µć“ś±ķµÄČÜŅŗÖŠc(H+ )Óėc£ØOH-£©³Ė»żĻąµČ
D£®Fe£ØOH£©3 ”¢Cu£ØOH£©2 ·Ö±šŌŚb”¢cĮ½µć“ś±ķµÄČÜŅŗÖŠ“ļµ½±„ŗĶ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ¹ć¶«¹ćÖŻÖ“ŠÅ֊ѧø߶žÉĻĘŚÖŠĪÄ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ?????
æÉŅŌÓĆÓŚ¼ų±šµķ·ŪČÜŅŗŗĶµ°°×ÖŹČÜŅŗµÄ·½·ØŹĒ( )
A£®·Ö±š¼ÓČėµāĖ®£¬¹Ū²ģŃÕÉ«·“Ó¦
B£®·Ö±š¼ÓČČ£¬¹Ū²ģŹĒ·ńÉś³É³Įµķ
C£®¼ÓČėµķ·ŪĆø¹Ū²ģŹĒ·ńĖ®½ā
D£® ·Ö±š¼ÓČėKIČÜŅŗ£¬¹Ū²ģŃÕÉ«·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ¹ć¶«¹ćÖŻÖ“ŠÅ֊ѧø߶žÉĻĘŚÖŠĪÄ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ?????
ĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½²»ÕżČ·µÄŹĒ
A£®ĀČ»Æ±µŗĶĻ”ĮņĖį·“Ó¦£ŗBa2++SO42- = BaSO4”ż
B£®ĢśÓėĻ”ŃĪĖį·“Ó¦£ŗ2Fe + 6H+ = 2Fe3+ + 3H2”ü
C£®ŠæÓėĮņĖįĶČÜŅŗ·“Ó¦£ŗZn+Cu2+ = Zn2++Cu
D£®ĒāŃõ»ÆÄĘŗĶŃĪĖį·“Ó¦£ŗOH-+ H+ = H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģÕć½ĮŁŗ£ĢØ֯֊ѧøßČżÉĻѧʌµŚČż“ĪĶ³Į·»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÉčNA“ś±ķ°¢·üŁ¤µĀĀŽ³£ŹżµÄŹżÖµ£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®³£ĪĀ³£Ń¹ĻĀ£¬1molŗ¤Ęųŗ¬ÓŠµÄŗĖĶāµē×ÓŹżĪŖ4NA
B£®0.25mol Na2O2ÖŠŗ¬ÓŠµÄŅõĄė×ÓŹżĪŖ0.5NA
C£®50ml 18.4mol/LÅØĮņĖįÓė×ćĮæĶĪ¢ČČ£¬Éś³ÉĘųĢå0.46NA
D£®25”ꏱ£¬7g C2H4ŗĶC3H6µÄ»ģŗĻĘųĢåÖŠ£¬ŗ¬ÓŠNAøöC”ŖH¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğø£½ØČżĆ÷Ņ»ÖŠøßŅ»ÉĻѧʌµŚ¶ž“ĪŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
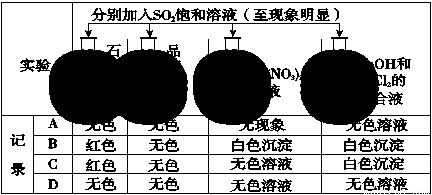
ŹµŃé±Øøę¼ĒĀ¼µÄŹµŃéĻÖĻóÕżČ·µÄŹĒ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com