
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题: 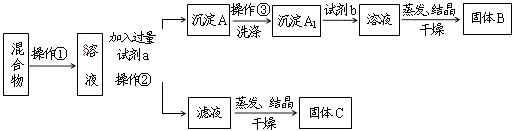
(1)操作①的名称是 , 操作②的名称是 .
(2)试剂a是 , 试剂b是 , 固体B是 . (填化学式)
(3)加入试剂a所发生的反应的离子方程式为: . 加入试剂b所发生反应的离子方程式为: .
(4)该方案能否达到实验目的: . 若不能,应如何改进(若能,此问不用回答) .
【答案】
(1)溶解,过滤
(2)K2CO3,HCl,BaCl2
(3)CO32﹣+Ba2+=BaCO3↓,BaCO3+2H+=Ba2++CO2↑+H2O
(4)否,在应滤液中加入过量盐酸后再蒸发结晶
【解析】解:分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl.(1)将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作,
所以答案是:溶解;过滤;
(2)固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,
所以答案是:K2CO3;HCl;BaCl2;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,发生的离子方程式为CO32﹣+Ba2+=BaCO3↓,
加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
所以答案是:CO32﹣+Ba2+=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O;
(4)滤液为KCl和K2CO3的混合物,⑥蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾,
所以答案是:否;在应滤液中加入过量盐酸后再蒸发结晶.


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.高温下用焦炭还原SiO2制取粗硅
B.晶体硅熔点高硬度大,因此可用于制作半导体材料
C.石英只能用于生产光导纤维
D.玻璃容器可长期盛放各种酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图1(已知2KI+Cl2=2KCl+I2 , 碘与溴一样易溶于有机溶剂):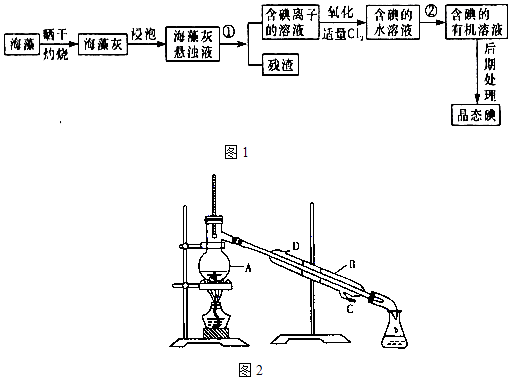
(1)图2中A 仪器的名称是 , 仪器B中冷凝水的水流方向: .
(2)提取碘的过程中,可供选择的有机试剂是 . (填字母)
A.苯
B.四氯化碳
C.酒精
D.醋酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 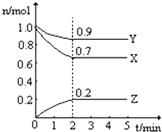
(1)该反应的化学方程式为;
(2)从开始至2min,Z的平均反应速率为;
(3)若X、Y、Z均为气体,反应达平衡时:此时体系的压强是开始时的倍.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过下图所示路线合成.A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8 . 
已知: ![]()
请回答以下问题:
(1)A的结构简式是;
(2)H→I的反应方程式 , B与银氨溶液反应的化学方程式是;
(3)C→D的反应类型是 , I→J的反应类型是;
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是;
(5)满足以下条件的F的同分异构体(含F)共有(填数字)种,
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有如 ![]() 结构
结构
③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( ) 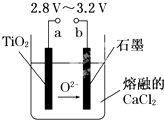
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e﹣═Ti+2O2﹣
D.每生成0.1mol钛,转移电子0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( ) 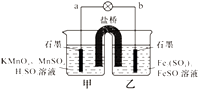
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜不能与稀硫酸反应,却能与浓硫酸反应,反应的方程式为:Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑
请回答:
(1)若有1mol铜反应,则参与还原反应的H2SO4物质的量为 .
(2)现用12.8g铜与足量的浓硫酸反应,可生成标准状况下SO2的体积是多少升?(写出计算过程)
(3)若用100mL 18.4mol/L的浓硫酸与足量的铜反应,却不能得到0.92mol的SO2 . 原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com