
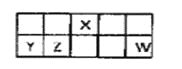
【题目】短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:
(1)写出W的离子结构示意图________________
(2)比较W 与Z的最高价氧化物对应水化物酸性的强弱 (写化学式)
(3)写出X的氢化物的电子式 ,写出X氢化物的水溶液与X的最高价氧化物对应的水化物的水溶液反应的离子方程式_____________________
(4)已知:①C(s)+ O2(g)= CO2(g) △H="a" kJ· mol-1;
②CO2(g) +C(s)="2CO(g)" △H="b" kJ· mol-1;
③Si(s)+ O2(g)=SiO2(s) △H="c" kJ· mol-1。写出工业生产中用碳粉还原二氧化硅制取粗硅的热化学方程式_________________________;
【答案】(1) (2)HClO4>H2SiO3
(2)HClO4>H2SiO3
(3)![]() NH3·H2O+H+=NH4++H2O
NH3·H2O+H+=NH4++H2O
(4)2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1
【解析】试题分析:短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,Y所处的周期序数与族序数相等,短周期元素,则Y为第三周期第ⅢA族元素,即Y为Al,由元素的位置可知,Z为Si,X为N,W为Cl;
(1)Cl原子的核电荷数为16,则Cl-的离子结构示意图为 ;
;
(2)Cl的非金属性比Si强,则最高价氧化物对应水化物酸性的强弱HClO4>H2SiO3;
(3)N的氢化物为NH3,其电子式为![]() ;NH3水溶液与N的最高价氧化物对应的水化物HNO3的水溶液反应生成硝酸铵的离子方程式为NH3·H2O + H+= NH4++ H2O;
;NH3水溶液与N的最高价氧化物对应的水化物HNO3的水溶液反应生成硝酸铵的离子方程式为NH3·H2O + H+= NH4++ H2O;
(4)已知①C(s)+O2(g)=CO2(g) △H=akJ·mol-1;
②CO2(g)+C(s)=2CO(g) △H=bkJ·mol-1;
③Si(s)+O2(g)=SiO2(s) △H=ckJ·mol-1,根据盖斯定律可知①+②-③可得
2C(s)+SiO2(s)=Si(s)+2CO(g),此反应的△H=(a+b-c)kJ·mol-1,
热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g) △H=(a+b-c)kJ·mol-1。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 2-甲基丁烷也称异丁烷 B. 由乙烯生成乙醇属于加成反应
C. C4H9Cl有3中同分异构体 D. 油脂和蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g) △H1=a kJ/mol;
FeO(s)+CO(g) △H1=a kJ/mol;
②CO(g)+1/2O2(g)![]() CO2(g) △H2=b kJ/mol
CO2(g) △H2=b kJ/mol
测得在不同温度下,反应①的平衡常数K值随温度的变化如下:

(1)若500℃时进行反应①,CO2起始浓度为2 mol·L-1,CO的平衡浓度为__________。
(2)反应①中的a______0(填“大于”“小于”或“等于”)。
(3)700℃反应①达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有_______(填序号)
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
(4)下列图像符合反应①的是____(填序号)(图中v是速率、![]() 为混合物中CO含量,T为温度且T1> T2)
为混合物中CO含量,T为温度且T1> T2)

(5)2Fe(s)+O2(g)![]() 2FeO(s) △H3,该反应的△H3=____________kJ/mol。(用含a、b的代数式表示)
2FeO(s) △H3,该反应的△H3=____________kJ/mol。(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学反应能量变化相关的叙述正确的是
A.生成物的总能量一定低于反应物的总能量
B.拆开物质中的化学键一定需要吸收能量
C.应用盖斯定律,无法计算某些难以直接测量的反应焓变
D.化学反应都伴随着能量和其他各种现象的出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图装置来验证卤族元素性质的递变规律。

据如图回答:
(1)甲同学设计实验的依据是____________________________________。
(2)写出选用的化学试剂:B____________,其作用为___________。
(3)C中反应的离子方程式为____________________________________________。
据如图回答:
乙同学的实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫红色。
(4)写出B处反应的离子方程式 ___________________________________________。
(5)A中验证氯气的氧化性强于碘的实验现象是_____________________。
(6)过程Ⅲ实验的目的是_________________________。
(7)综合甲、乙两同学的实验得出的结论是:同主族元素从上到下元素的非金属逐渐减弱,其原因是___________________________________________(试从原子结构角度解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
①溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
②酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大
A.①② B.② C.②③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为:r(y)>r(x)>r(z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是
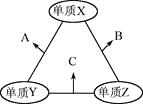
A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸点高于C的沸点
D. A和C不可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列食品化学知识的叙述正确的是
A. 新鲜蔬菜做熟后,所含维生素C会有损失
B. 油脂、淀粉、蛋白质均为可水解的高分子化合物
C. 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
① ![]() ② (CH3)2CHCH2Cl ③ (CH3)3CCH2Cl ④ CHCl2-CHBr2 ⑤
② (CH3)2CHCH2Cl ③ (CH3)3CCH2Cl ④ CHCl2-CHBr2 ⑤ ![]() ⑥ CH2Cl2
⑥ CH2Cl2
A.①③⑥ B.②③⑤ C.全部 D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com