
| A. | ①②③ | B. | ②③⑤ | C. | ①③④ | D. | ②③④ |
科目:高中化学 来源: 题型:选择题
| A. | 胶体是纯净物 | |
| B. | 胶体的分散质有可能带电,但胶体不带电 | |
| C. | 胶体、溶液与浊液的本质区别在于是否有丁达尔效应 | |
| D. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中,可得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol•L-1 氯化钠溶液 | B. | 75mL 1.5mol•L-1氯化钙溶液 | ||
| C. | 150mL3mol•L-1 氯化钾溶液 | D. | 75mL 1mol•L-1 氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三聚氰胺的摩尔质量为126g/mol | |
| B. | 三聚氰胺分子中各元素原子的物质的量之比为n(C):n(H):n(N)=1:2:2 | |
| C. | 三聚氰胺分子中各元素的质量比为m(C):m(H):m(N)=6:1:14 | |
| D. | 标准状况下,1mol三聚氰胺所占的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
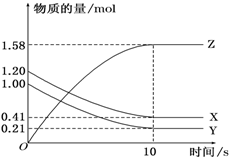 一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
一定温度下,某1L体积固定的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com