
| A.气体甲一定不是SO2 | B.气体甲一定是Cl2 |
| C.气体甲一定不是发生了化合反应 | D.气体甲一定被溶液乙氧化 |


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤ | B.②④ | C.①②③⑤ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol·L-1的H2SO4,振荡。 | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
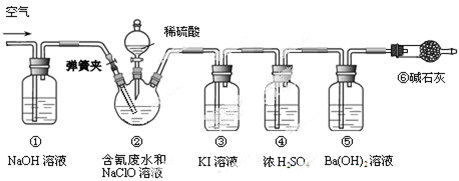
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.35Cl、37 Cl为互为同位素,有不同的化学性质 |
| B.氯气和二氧化硫使品红褪色的原理相同 |
| C.浓硝酸和浓硫酸在空气中放置一段时间后浓度都会降低 |
| D.卤化氢在空气中都能形成白雾,它们都是强电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向氯水中通入少量二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得结论出 |
| 氯水中何种物质能使湿润的红色布条退色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ① ② ③ ④H2O使布条退色 | ①:实验①:把红色干布条放入充满氯气的集气瓶中,布条不退色 实实验②: ; 实验③:把红色布条放在水里,布条不退色 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com