
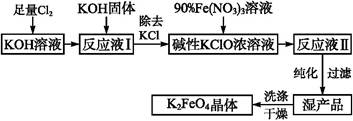
 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低) 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高) 2K2FeO4+6KNO3+3KCl+5H2O
2K2FeO4+6KNO3+3KCl+5H2O ;② 。
;② 。  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑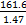 mL=
mL=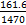 L,n(KOH)=
L,n(KOH)=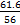 mol,物质的量浓度=
mol,物质的量浓度=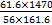 mol·L-1
mol·L-1

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:不详 题型:实验题

| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
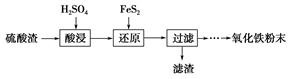
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③④ | C.②③⑤ | D.②④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分液、蒸馏 | B.蒸馏、分液 | C.分液、萃取 | D.萃取、分液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| B.向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ |
| C.向某溶液中滴加少量氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ |
| D.向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |

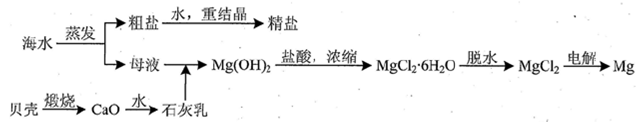
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3溶液 | B.KMnO4溶液 | C.溴水 | D.CCl4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com