
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
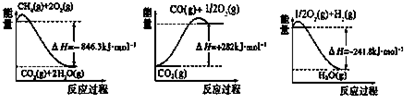
分析 (1)①CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
依据盖斯定律计算①×2+②+3得到催化反应室中的总反应的热化学方程式:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g);
产业链中某反应的平衡常数表达式为K=$\frac{c({H}_{2})c(CO)}{c({H}_{2}O)}$,反应的化学方程式为:H2O(g)+C(s)?H2(g)+CO(g),每生成1mol H2需要吸收131.3kJ的热量,生成2g氢气放热131.3KJ,结合热化学方程式书写方法写出,标注物质聚集状态和对应反应的焓变;
(2)结合化学平衡三行计算列式计算,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.6 1.4 0
变化量(mol/L) 0.3 0.6 0.3
8min量(mol/L) 0.3 0.8 0.3
反应速率v=$\frac{△c}{△t}$;
(3)①先计算浓度商,根据浓度商与化学平衡常数相对大小确定反应方向,从而确定正逆反应速率相对大小;
②根据化学平衡常数计算平衡时二甲醚的物质的量浓度;
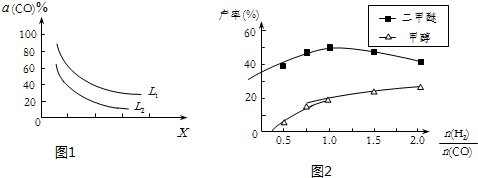
(4)3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-262.7kJ•mol-1,反应为气体体积减小的放热反应,温度升高平衡逆向进行,CO转化率减小,增大压强平衡正向进行,CO转化率增大;
(5)当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大.
解答 解:(1)①CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
依据盖斯定律计算①×2+②+3得到催化反应室中的总反应的热化学方程式:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-262.7kJ•mol-1,
产业链中某反应的平衡常数表达式为K=$\frac{c({H}_{2})c(CO)}{c({H}_{2}O)}$,反应的化学方程式为:H2O(g)+C(s)?H2(g)+CO(g),每生成1mol H2需要吸收131.3kJ的热量,生成2g氢气放热131.3KJ,结合热化学方程式书写方法写出,C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ•mol-1,
故答案为:-262.7kJ•mol-1,C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ•mol-1;
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol•L-1,c(H2)=1.4mol•L-1,8min后达到平衡,CO的转化率为50%,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.6 1.4 0
变化量(mol/L) 0.3 0.6 0.3
8min量(mol/L) 0.3 0.8 0.3
反应速率v=$\frac{△c}{△t}$=$\frac{0.6mol/L}{8min}$=0.075 mol•L-1•min-1,
则8min内H2的平均反应速率为0.075 mol•L-1•min-1,
故答案为:0.075 mol•L-1•min-1;
(3)①2CH3OH(g)?CH3OCH3(g)+H2O(g),浓度商=$\frac{1×1}{0.4{6}^{2}}$=4.7<400,平衡正向移动,则v正 大于 v逆,
故答案为:大于;
②设达到平衡时二甲醚反应的物质的量浓度为xmol/L,
该反应2CH3OH(g)?CH3OCH3(g)+H2O
开始(mol/L) 0.46 1 1
反应(mol/L) 2x x x
平衡(mol/L )0.46-2x 1+x 1+x
化学平衡常数K=$\frac{(1+x)^{2}}{(0.46-2x)^{2}}$=400
x=0.2,
则平衡时二甲醚的物质的量浓度=(1+0.2)mol/L=1.2mol/L,
故答案为:>; 1.2 mol•L-1;
(4)3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-262.7kJ•mol-1,反应为气体体积减小的放热反应,温度升高平衡逆向进行,一氧化碳转化率减小,增大压强平衡正向进行,一氧化碳转化率增大,图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件,
故答案为:温度;图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件;
(5)图象中曲线变化特征分析,二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小,
故答案为:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小;
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,灵活运用三段式是解本题关键,会利用化学平衡常数与浓度商的关系确定反应方向,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题

| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9mL | B. | 小于9mL | ||
| C. | 大于9 mL | D. | 因操作错误无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
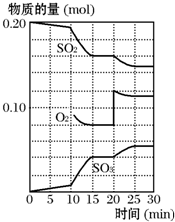 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯乙烯(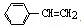 )中含有的C=C数为4NA )中含有的C=C数为4NA | |
| B. | 标准状况下,2.24L己烷含有的分子数为0.1NA | |
| C. | 1mol甲基含10NA个电子 | |
| D. | 某温度下,2.6g乙炔和苯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com