
 ,反应类型为缩聚反应.
,反应类型为缩聚反应. (须注明反应条件).
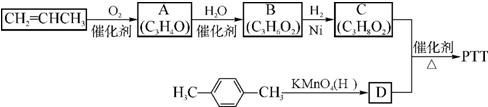
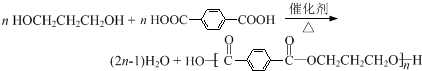
(须注明反应条件).分析 A、B、C均为链状化合物,A能发生银镜反应,则A是醛,丙烯被氧气氧化生成A,结合丙烯与A的分子式可知,则A为CH2=CHCHO,A和水发生加成反应生成B,B和氢气发生加成反应生成C,C中不含甲基,1mol C可与足量钠反应生成22.4L H2(标准状况),结合其分子式知,C中含有两个醇羟基,且C中两个羟基位于链端,则C为HOCH2CH2CH2OH,B为HOCH2CH2CHO,对二甲苯被酸性高锰酸钾溶液氧化生成D为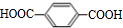 ,C和D发生缩聚反应生成PTT为
,C和D发生缩聚反应生成PTT为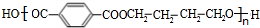 .
.
解答 解:A、B、C均为链状化合物,A能发生银镜反应,则A是醛,丙烯被氧气氧化生成A,结合丙烯与A的分子式可知,则A为CH2=CHCHO,A和水发生加成反应生成B,B和氢气发生加成反应生成C,C中不含甲基,1mol C可与足量钠反应生成22.4L H2(标准状况),结合其分子式知,C中含有两个醇羟基,且C中两个羟基位于链端,则C为HOCH2CH2CH2OH,B为HOCH2CH2CHO,对二甲苯被酸性高锰酸钾溶液氧化生成D为 ,C和D发生缩聚反应生成PTT为
,C和D发生缩聚反应生成PTT为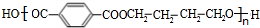 .
.
(1)通过以上分析知,A为CH2=CHCHO,含有的官能团为碳碳双键、醛基,B的结构简式为HOCH2CH2CHO,
故答案为:碳碳双键、醛基;HOCH2CH2CHO;
(2)HOCH2CH2CH2OH和 发生缩聚反应生成PTT,反应方程式为:
发生缩聚反应生成PTT,反应方程式为: ,
,
故答案为: ,缩聚反应;
,缩聚反应;
(3)丙烯和氯气发生加成反应生成1,2-二氯丙烷,1,2-二氯丙烷和氢氧化钠的水溶液发生取代反应生成1,2-丙二醇,1,2-丙二醇被氧化生成CH3COCHO,CH3COCHO被氧化生成CH3COCOOH,CH3COCOOH发生还原反应生成2-羟基丙酸,合成路线流程图为: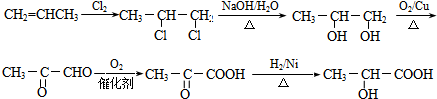 ,
,
故答案为: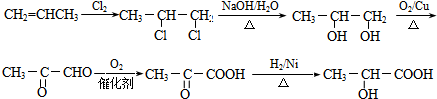 .
.
点评 本题考查有机物的推断,注意根据转化关系转化有机物的分子式、反应条件进行推断,对学生的推理有一定的要求,需要学生熟练掌握有机物的结构和性质,注意苯环支链上连接苯环的碳原子上含有氢原子的能被酸性高锰酸钾氧化生成苯甲酸.


科目:高中化学 来源: 题型:解答题
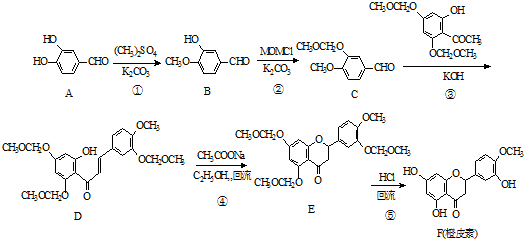
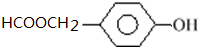 .
.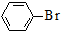 和CH3CHO为原料制备化合物
和CH3CHO为原料制备化合物 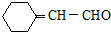 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 0.5 mol CO2 中所含的CO2 分子数为 3.01×1023 | |
| C. | 标准状况下,6.02×1022 个CO2 所占的体积约是 22.4 升 | |
| D. | 在 l L 水中溶解5.85g NaCl固体,即可配制得0.1 mo1/L 的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
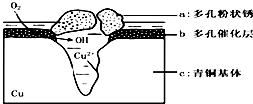 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3 Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极b被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145gCu 2 ( OH)3 Cl,则理论上消耗标准状况氧气体积为 0.448L | |
| D. | 正极的电极反应式为:正极反应是 O2+4e-+2H2O═4OH-- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂△}^{O_{2}}$NO$→_{H_{2}O}^{O_{2}}$HNO3 | |
| B. | 浓HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$\stackrel{电解}{→}$Al | |
| D. | 淀粉$→_{△}^{H_{2}SO_{4}(aq)}$葡萄糖$\stackrel{酒化酶}{→}$C2H5OH$→_{Ag,△}^{O_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
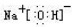 (写电子式,下同),既含有非极性共价键又含有离子键的化合物为
(写电子式,下同),既含有非极性共价键又含有离子键的化合物为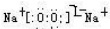 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Cl-<Mg2+<Na+ | B. | 非金属性:Si<C<N | ||
| C. | 碱性:Mg(OH)2<NaOH<KOH | D. | 稳定性:PH3<NH3<H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;
;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com