
 ,Na在氧气中完全燃烧所得产物的电子式为
,Na在氧气中完全燃烧所得产物的电子式为

分析 (1)主族周期数=电子层数、族序数=最外层电子数;Na的原子核外有三鼐电子层,最外层电子数是1,Na在氧气中完全燃烧所得产物的为过氧化钠;
(2)某种元素的氢化物和该元素的最高价含氧酸反应可以生成盐,则该元素为N元素,实验室用氢氧化钙与氯化铵在加热的条件下制备氨气,同时生成氯化钙与水;
(3)所有元素中H原子半径最小;F元素非金属性最强;Si单质能用于芯片制造;
(4)①若A由两种元素组成,常温下呈液态,组成单质B的元素是短周期中原子半径最大的,则B为Na,A为H2O,结合转化关系可知,C为氢氧化钠、D为氢气、E为氧气;
②若B是地壳中含量最高的金属元素的单质,则B为Al,E为水,D与E的反应在高温下进行,D与E的反应为铝热反应,则A为四氧化三铁、C为氧化铝,D为Fe;
③若B是一种正盐,其焰色反应呈黄色,含有Na元素,向B的溶液中通入黄绿色气体A,出现黄色沉淀,可推知A为氯气、B为Na2S.
解答 解:(1)Al原子有3个电子层,最外层电子数为3,处于周期表中第三周期ⅢA族,Na的原子核外有三鼐电子层,最外层电子数是1,原子结构示意图为 ,Na在氧气中完全燃烧所得产物的为过氧化钠,其电子式为
,Na在氧气中完全燃烧所得产物的为过氧化钠,其电子式为 ,
,
故答案为:第三周期ⅢA族; ;
;
(2)某种元素的氢化物和该元素的最高价含氧酸反应可以生成盐,则该元素为N元素,实验室用氢氧化钙与氯化铵在加热的条件下制备氨气,同时生成氯化钙与水,反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)所有元素中H原子半径最小;F元素非金属性最强;Si单质能用于芯片制造,
故答案为:H;F;Si;
(4)①若A由两种元素组成,常温下呈液态,组成单质B的元素是短周期中原子半径最大的,则B为Na,A为H2O,结合转化关系可知,C为氢氧化钠、D为氢气、E为氧气,则反应①的方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
②若B是地壳中含量最高的金属元素的单质,则B为Al,E为水,D与E的反应在高温下进行,D与E的反应为铝热反应,则A为四氧化三铁、C为氧化铝,D为Fe,A的化学式为Fe3O4,
故答案为:Fe3O4;
③若B是一种正盐,其焰色反应呈黄色,含有Na元素,向B的溶液中通入黄绿色气体A,出现黄色沉淀,可推知A为氯气、B为Na2S,反应①的离子方程式为S2-+Cl2=S↓+2Cl-,
故答案为:S2-+Cl2=S↓+2Cl-.
点评 本题考查无机物推断、结构性质位置关系应用等,难度不大,(4)中推断需要学生熟练掌握元素化合物知识.


科目:高中化学 来源: 题型:选择题
| A. | ac | B. | be | C. | df | D. | gh |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
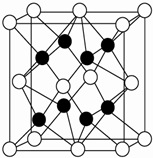 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 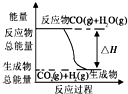 如图表示反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H>0 | |
| B. | 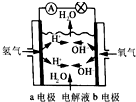 如图为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1 | |
| C. | 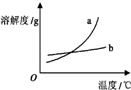 如图表示物质a、b的溶解度曲线,可以用重结晶方法从a、b混合物中提纯a | |
| D. |  如图可以表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,且乙的压强小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 乙醛与新制Cu(OH)2浊液反应:NaOH+CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O | |
| C. | 实验室用液溴和苯在催化剂作用下制溴苯: +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$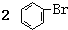 | |
| D. | 将CO2通入苯酚钠溶液: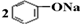 +CO2+H2O→ +CO2+H2O→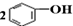 +Na2CO3 +Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的原子,其核外电子排布也相同 | |
| B. | 质量数相同的不同原子,其化学性质一定相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶化合物 | |
| C. | 强电解质的水溶液导电能力强,弱电解质导电能力弱 | |
| D. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH(CH3)OH | B. | CH3(CH2)3CH2OH | C. | CH3CH2C(CH3)2OH | D. | (CH3CH2)2CHOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com