

分析 (1)根据氢氧化铁和氢氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠;钨酸钠和浓盐酸反应生成钨酸和氯化钠,氢气还原氧化钨生成钨和水,书写化学方程式;
(2)根据在化合物中正负化合价代数和为零,进行解答.
解答 解:(1)熔融FeWO4、MnWO4和氢氧化钠反应生成氢氧化铁、氢氧化锰和钨酸钠,氢氧化铁和氢氧化锰不溶于水,钨酸钠易溶于水,经过水浸、过滤,A为钨酸钠;
钨酸钠和浓盐酸反应生成钨酸和氯化钠,化学方程式为:Na2WO4 +2HCl═H2WO4↓+2NaCl;钨酸高温生成氧化钨,氢气还原氧化钨生成钨和水,化学方程式为:WO3 +3H2 $\frac{\underline{\;高温\;}}{\;}$W+3H2O,
故答案为:Na2WO4;Na2WO4 +2HCl═H2WO4↓+2NaCl;WO3 +3H2 $\frac{\underline{\;高温\;}}{\;}$ W+3H2O;
(2)这种氧化钨中存在五价和六价两种价态的钨,设钨的平均价态为x,则x+(-2)×2.9=0,解得x=+5.8,化合物中正负化合价代数和为零,设每个WO2.9的分子中五价的原子个数为a,六价的原子个数为b,则有5a+6b=5.8和a+b=1解之得,b=0.8,可知这两种价态的钨原子数之比为1:4.
故答案为:1:4.
点评 本题主要考查学生常见金属的冶炼知识,并考查根据在化合物中正负化合价代数和为零进行分析解题的能力以及正确书写化学方程式的能力,需要学生在平时多加练习.


科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 1.5 mol•L-1氯化钾溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含质子数相等 | |
| C. | 标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等 | |
| D. | 12g C和16g O所含的原子数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B的原子结构示意图为
,B的原子结构示意图为 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧贴烧杯内壁 | |
| B. | 分液时,下层液体应从分液漏斗下口放出,上层液体从上口倒出 | |
| C. | 蒸馏时,在蒸馏烧瓶中盛约 $\frac{1}{3}$体积的液体,并放入几粒沸石,将温度计水银球插入液体中,冷水从冷凝管下口进,上口出,收集时,应弃去开始馏出的部分液体 | |
| D. | 加热蒸发氯化钠溶液时,加热到有大量晶体析出时即停止加热,不能加热到全部蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
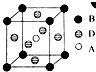 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com