
分析 (1)精确配制250mL待测溶液,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶,据此滴定的操作要求可知,滴定时,左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液的颜色变化,当看到溶液出现浅紫红色且保持30s不变时,达滴定终点;
(2)根据c(待测)=$\frac{C(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断.
解答 解:(1)精确配制250mL待测溶液,配制时需要的玻璃仪器有玻棒、烧杯、胶头滴管、250mL容量瓶,据此滴定的操作要求可知,滴定时,左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液的颜色变化,当看到溶液出现浅紫红色且保持30s不变时,达滴定终点;
故答案为:玻棒、250mL容量瓶;锥形瓶内溶液的颜色变化;溶液出现浅紫红色且保持30s不变;
(2)滴定操作中,锥形瓶残留少量蒸馏水,对V(标准)无影响,根据c(待测)=$\frac{C(标准)V(标准)}{V(待测)}$分析,测定结果无影响;
达到滴定终点时,尖嘴处尚有一滴液滴未滴下,标准溶液体积增大,根据c(待测)=$\frac{C(标准)V(标准)}{V(待测)}$分析,测得的结果偏高;
故答案为:无影响,偏高.
点评 本题考查了一定物质的量浓度溶液的配制,氧化还原滴定法测溶液的物质的量的浓度,掌握配制一定物质的量浓度溶液、氧化还原滴定原理是解题关键,试题培养了学生的分析能力及化学计算、化学实验能力,题目难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
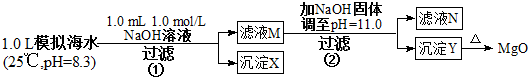
| 海水中的离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
| A. | 沉淀物X为CaCO3,MgCO3 | |
| B. | 滤液M中存在Mg2+,不存在Ca2+ | |
| C. | 滤液N中存在Mg2+、Ca2+ | |
| D. | 步骤②中若改为加入8 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
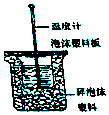 Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
Ⅰ.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题.| 实验用品 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.3℃ |
| ② | 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 23.5℃ |
| 50ml0.55mol/LNaOH | 50ml0.5mol/LHCl | 20℃ | 21.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中醋酸根浓度与醋酸分了浓度比值变大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
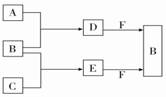 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图所示(反应条件和部分产物略去).下列说法中不正确的是( )| A. | F中阴阳离子个数比为1:1 | |
| B. | 化合物F中既有离子键又有共价键 | |
| C. | 合成过程中的反应均是氧化还原反应 | |
| D. | 1mol F与E反应时转移的电子数为NA(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据要求回答问题:
根据要求回答问题: .
. .分子中可能处于同一平面上的碳原子最多有4个.
.分子中可能处于同一平面上的碳原子最多有4个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
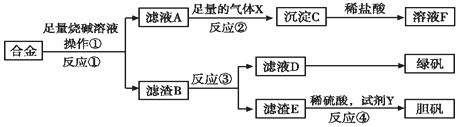
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:W>Z>X | B. | 单质熔点:W>Z | ||
| C. | 最高正价:W>X>Y>Z | D. | 原子序数:Z>W>X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com