
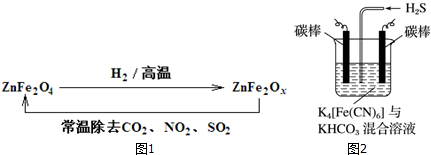
分析 (1)Fe2+的水解程度大于NH4+,水解程度越大,离子浓度越小,Fe2+和NH4+水解溶液显酸性;
(2)溶液pH约为7,c(OH-)=10-7mol/L,根据Ksp(Fe(OH)3=c(Fe3+)×c3(OH-)计算;KMnO4将Mn2+氧化为固相的+4价锰的化合物,则生成二氧化锰;
(3)①根据化合价的变化判断氧化剂;
②用ZnFe2Ox除去NO2的过程中,若x=3,则铁显+2价,将NO2还原为氮气,根据电子得失守恒有关系式2ZnFe2Ox~NO2,据此计算ZnFe2Ox的质量;
③用ZnFe2O4制取ZnFe2Ox的过程中,若x=3.5,则ZnFe2Ox中铁显+2.5价,根据电子得失守恒计算ZnFe2O4与H2反应的物质的量之比;
(4)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,据此判断.
解答 解:(1)硫酸铁铵[NH4Fe(SO4)2•12H2O]溶于水形成的溶液中,Fe3+和NH4+水解溶液显酸性,Fe3+的水解程度大于NH4+,水解程度越大,离子浓度越小,所以c(NH4+)>c(Fe2+),硫酸根离子不水解,浓度最大,所以溶液中离子浓度关系c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-),
故答案为:c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-);
(2)溶液pH约为7,c(OH-)=10-7mol/L,Ksp(Fe(OH)3=c(Fe3+)×c3(OH-)=4.0×10-38,则c(Fe3+)=$\frac{4.0×10{\;}^{-38}}{(10{\;}^{-7})^{3}}$=4.0×10-17mol/L;KMnO4将Mn2+氧化为固相的+4价锰的化合物,则生成二氧化锰,其反应的离子方程式为:2MnO4-+3Mn2++2H2O=5MnO2+4H+;
故答案为:4.0×10-17;2MnO4-+3Mn2++2H2O=5MnO2+4H+;
(3)①新型纳米材料ZnFe2OX可由化合物ZnFe2O4经高温还原制得,故ZnFe2OX和SO2反应得到ZnFe2O4过程中铁的化合价升高,也可由①计算可知,故ZnFe2OX作还原剂,则SO2作氧化剂;
故答案为:SO2;
②用ZnFe2Ox除去NO2的过程中,若x=3,则铁显+2价,将NO2还原为氮气,根据电子得失守恒有关系式2ZnFe2Ox~NO2,所以消除1mol NO2时,消耗ZnFe2Ox的物质的量为2mol,所以ZnFe2Ox的质量为2mol×225g/mol=450g,
故答案为:450;
③用ZnFe2O4制取ZnFe2Ox的过程中,若x=3.5,则ZnFe2Ox中铁显+2.5价,ZnFe2O4中铁显+3价,氢气由0价变为+1价,根据电子得失守恒可知关系式:2ZnFe2O4~H2,ZnFe2O4与H2反应的物质的量之比为2:1,
故答案为:2:1;
(4)电解时,阳极的电极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3-,电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大;
故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;变大.
点评 本题考查了离子浓度大小比较、氧化还原反应、溶度积常数的计算及电解等,题目综合性较强,注重对学生综合能力的考查,把握习题中的信息及迁移应用为解答的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36 L煤油含有9.03×1022个煤油分子 | |
| B. | 常温常压下,2 g氢气含有的原子数为1.204×1024个 | |
| C. | 同温同压下,相同体积的任何气体所含的原子数相等 | |
| D. | 22.4 L气体所含分子数一定大于11.2 L气体所含分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
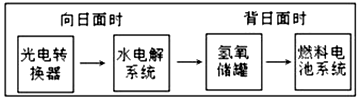 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统将电能转化为化学能 | |
| C. | 水电解系统中的阳极反应:4OH-═2H2O+O2↑+4e- | |
| D. | 燃料电池放电时的负极反应:H2+2OH-═2H2O+2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3与CH3CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2具有氧化性,在反应中只做氧化剂 | |
| B. | 1735Cl、1737Cl为不同的核素,但化学性质几乎完全相同 | |
| C. | 实验室用加热NH4Cl固体的方法来制备NH3 | |
| D. | 1.12L Cl2含有1.7NA个质子(NA表示阿伏伽德罗常数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com