
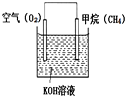
 甲烷燃料电池是使用气体燃料和氧气直接反应产生电能,一种很有前途的能源利用方式,它的优势在于
甲烷燃料电池是使用气体燃料和氧气直接反应产生电能,一种很有前途的能源利用方式,它的优势在于

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 NH3H2O+H+
NH3H2O+H+ NH3H2O+H+
NH3H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(11 分)科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3,反应的化学方程式如下:N2(g)+ 3H2O(l) 2NH3(g)+ O2(g)。回答下列问题:
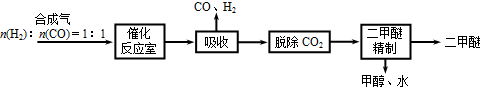
(1)进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h),则该反应的正反应为 反应(填“吸热”或“放热”)
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数
据如下:
H2(g) :△H=-285.8 kJ・mol-1;
CO(g) :△H =-283.0 kJ・mol-1;
CH4(g) :△H=-890.3 kJ・mol-1 。
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式__________________________________。
(4)有人设想寻求适合的催化剂和电极材料,以N2、H2为电极反应物,以HCl——NH4Cl为电解质溶液制成新型燃料电池,请写出该电极的正极反应式
(5)生成的NH3可用于制铵态氮肥,如(NH4)2SO4、NH4Cl,这些肥料显 性,原因是(用离子方程式表示)___________________________,使用时避免与________________物质合施。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省吉安市高三上学期期末教学质量评价化学试卷(解析版) 题型:填空题
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是??????? 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g)? ΔH>0
CO(g) + 3H2(g)? ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定??
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定??????
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2013届天津市高二上学期期末考试化学试卷 题型:填空题
(11 分)科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3,反应的化学方程式如下:N2(g)+ 3H2O(l)  2NH3(g)+ O2(g)。回答下列问题:
2NH3(g)+ O2(g)。回答下列问题:
(1)进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h),则该反应的正反应为 反应(填“吸热”或“放热”)
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数
据如下:
H2(g) :△H =-285.8 kJ・mol-1;
CO(g) : △H =-283.0 kJ・mol-1;
CH4(g) :△H =-890.3 kJ・mol-1 。
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式__________________________________。
(4)有人设想寻求适合的催化剂和电极材料,以N2、H2为电极反应物,以HCl——NH4Cl为电解质溶液制成新型燃料电池,请写出该电极的正极反应式
(5)生成的NH3可用于制铵态氮肥,如(NH4)2SO4、NH4Cl,这些肥料显 性,原因是(用离子方程式表示)___________________________,使用时避免与________________物质合施。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com