
| A. | x=0.5,a=10 | B. | x=1,a=5 | C. | x=2,a=10 | D. | x=0.5,a=8 |
分析 由题目信息可知,Cr2O72-中Cr元素由+6价还原为+3价,FeS04中Fe元素被氧化为+3价,且Fe元素部分化合价未变化,根据电子转移守恒有3x=2-x,据此确定x的值;
计算处理1molCr2O72-时被氧化为+3价的Fe元素物质的量,进而计算复合氧化物中+2的Fe元素物质的量,根据Fe元素守恒计算FeS04•7H2O的物质的量.
解答 解:由题目信息可知,Cr2O72-中Cr元素由+6价还原为+3价,FeS04中Fe元素被氧化为+3价,且Fe元素部分化合价为变化,根据电子转移守恒计算有3x=2-x,解得x=0.5;
处理1molCr2O72-,根据电子转移守恒可知,被氧化为+3价的Fe元素物质的量为$\frac{1mol×2×(6-3)}{3-2}$=6mol,复合氧化物中+2的Fe元素与+3价Fe元素的物质的量之比为1:(2-x)=1:(2-0.5)=1:1.5,故算复合氧化物中+2的Fe元素物质的量为$\frac{6mol}{1.5}$=4mol,根据Fe元素守恒可知FeS04•7H2O物质的量为6mol+4mol=10mol,
故选:A.
点评 本题考查氧化还原法的有关计算,难度中等,注意根据电子转移守恒、原子守恒进行的计算.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红色的溶液中:Na+,K+,OH-,S2O${\;}_{3}^{2-}$ | |
| B. | 在加入铝粉能产生氢气的溶液中:NH${\;}_{4}^{+}$,Fe2+,SO${\;}_{4}^{2-}$,NO${\;}_{3}^{-}$ | |
| C. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+,NO${\;}_{3}^{-}$,K+,F- | |
| D. | 含大量Cu2+的溶液中:NH${\;}_{4}^{+}$,Na+,Cl-,HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
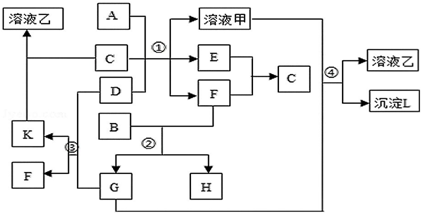
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 4.48L | C. | 5.6L | D. | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ④⑤⑥ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶用前内壁沾有水珠 | |
| C. | 加蒸馏水时,不慎超过了刻度线,用胶头滴管吸出 | |
| D. | 称量NaCl时砝码与药品放反了 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com