
| A、0.4 mol.L-1 |
| B、0.2 mol.L-1 |
| C、0.3 mol.L-1 |
| D、0.05mol.L-1 |
| 0.1mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、0.18mol/L |
| B、1.8×10-2 mol/L |
| C、1.8×10-6 mol/L |
| D、2.0×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、①③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、环形玻璃搅拌棒、温度计 |
| D | 分离乙醇和苯酚的混合物 | 分液漏斗、烧杯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
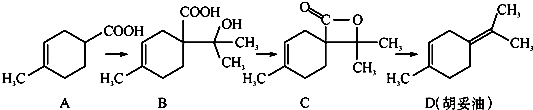
| A、若A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的属于加成反应 |
| B、有机物B既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 |
| C、有机物C的所有同分异构体中不可能有芳香族化合物存在 |
| D、有机物D分子中所有碳原子不一定共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
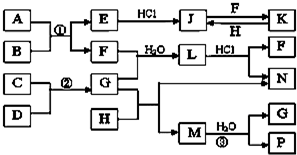 如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
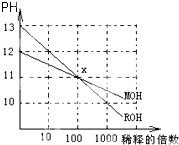 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )| A、等PH的MOH和ROH溶液,稀释相同倍数,ROH 溶液的PH略大 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、常温下pH之和为14的醋酸和ROH溶液等体积混合,溶液呈碱性 |
| D、在x点,c(M+)=c(R+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com