
【题目】CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
【答案】(1)89.6
(2)2.4 mol/L≥c≥1.2 mol/L
(3)![]()
![]() n(H2O)=(9/6)×2=3(mol)
n(H2O)=(9/6)×2=3(mol)
(4)300 mol CH4完全反应产生H2 900mol
设CO2转化率为α,CO转化率为β
300β+100α=350 600β+300α=900-120
α=80%
或设CO2转化率为α 900350×2100α=120 α=80/100=80%
【解析】
试题分析:
(1)碳酸氢铵分解的化学方程式为:NH4HCO3![]() H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+ n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。
H2O+NH3↑+CO2↑,从方程式可以看出,分解产物经干燥后,所得气体为NH3和CO2,且n(NH3)+ n(CO2)=2n(NH4HCO3)=2×2.00mol=4.00mol,则V(混合气体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。
(2)根据题意要求,2.40 molCO2被完全吸收,NaOH也完全反应,则反应的产物可能是Na2CO3(此时NaOH的浓度最大)或NaHCO3(此时NaOH的浓度最小)或Na2CO3和NaHCO3的混合物。用极值思想分析两个特殊情况:
①CO2+NaOH=NaHCO3,n(NaOH)= n(CO2)=2.40mol,则c(NaOH)=![]() =1.20mol/L;
=1.20mol/L;
②CO2+2NaOH=Na2CO3,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=![]() =2.40mol/L;
=2.40mol/L;
综合①、②可知,NaOH溶液的浓度应该1.20mol/L≤c(NaOH)≤2.40mol/L。
(3)法一:
依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:
8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2
所以有n(H2O)=![]() n(CO2)=
n(CO2)=![]() ×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。
×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。
法二:
设反应前密封舱内H2O的物质的量为n
4KO2 + 4CO2 + 2H2O → 4KHCO3 + 3O2
2n n 1.5n
4KO2 + 2CO2 → 2K2CO3 + 3O2
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+ 1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内
H2O的物质的量为3mol。
(4)法一:
CH4 + H2O → CO + 3H2
300mol 300mol 900mol
设CO2的转化率为α,CO的转化率为β
p>CO + 2H2 → CH3OH CO2 + 3H2 → CH3OH + H2O300βmol 600βmol 300βmol 100αmol 300αmol 100αmol
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol-------①式
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-350mol,所以有
600βmol+300αmol=900mol-350mol--------②式
由①②式可得α=0.8,即设CO2的转化率为80%。
法二:
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设CO2的转化率为α
CH4 + H2O → CO + 3H2
300mol 900mol
CO2 + 3H2 → CH3OH + H2O
100αmol 100αmol
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-350mol,根据反应中氢元素的守恒可有:900mol-120mol=350mol×2+100αmol,解得α=0.8,即设CO2的转化率为80%。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下:
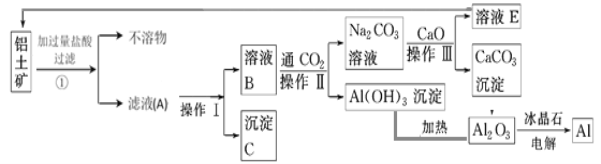
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有______________________ 。
(2)写出滤液A中一种溶质与过量NaOH溶液反应进入滤液B中的离子方程式_______________________________。
(3)若步骤①中没有过滤操作而直接进入步骤②,对后面操作将产生的影响是_______________________________。
(4)写出由溶液B生成Al(OH)3的离子方程式:_______________________________。
(5)工艺流程中涉及氧化还原反应的化学方程式为_______________________________。
(6)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有 (填化学式)。用此法制取铝的副产品是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氧元素与氟元素能形成OF2分子,该分子的空间构型为__________。
(2)与![]() 等电子体的分子 ,根据等电子体原理在
等电子体的分子 ,根据等电子体原理在![]() 中氮原子轨道杂化类型是__________;
中氮原子轨道杂化类型是__________;![]() 与N2是等电子体,1 mol
与N2是等电子体,1 mol![]() 中含有的π键数目为__________个。
中含有的π键数目为__________个。
(3)下列物质的分子与O3分子的结构最相似的是__________。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)O3分子是否为极性分子?__________。(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇可以有效利用资源,同时又可控制温室气体.原理为:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
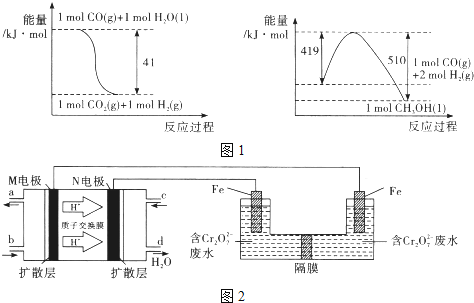
(1)由图1所示的能量变化,写出将CO2转化为甲醇的热化学方程式_____________。
(2)一定温度下,若上述制备甲醇的反应在体积为2L的密闭容器中进行并保持温度不变,起始时投入1moICO2、4molH2,达到平衡时H2与CO2的物质的量之比为8 :1 , CO2的转化率是_____________.
(3)以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含Cr2O72-)时,实验室利用图2装置模拟该法:
①M区发生反应的电极反应式为___________。
②己知电解池溶液里以Cr2O72-转化为Cr3+,该反应的离子方程式________________。
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当Cr3+沉淀完全,溶液的pH_______________。(己知Ksp[Cr(OH)3]=6.4×10-31,lg2=0.3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H16O2的有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条件可被氧化,最终转化成D,则A的可能结构有 ( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有水果香味的中性物质A可以发生下列变化:
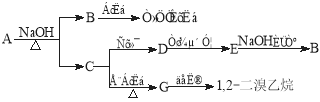
(1) 其中的弱酸是_____________________,G的结构简式为___________
(2) 写出下列变化的方程式:
A+NaOH→B+C的化学方程式:_____________________________________________
C→D的化学方程式:__________________________________________
D的银镜反应的离子方程式:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对教材中的铁与高温水蒸气反应的实验装置图做了如图所示的优化。通过观察硬质玻璃管Ⅱ和干燥管Ⅱ中的现象证明铁与水蒸气发生了反应,用试管收集产生的经干燥的气体,并靠近火焰点火,观察现象。
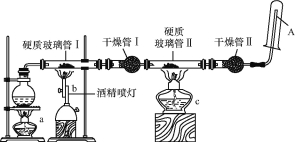
请回答下列问题:
(1)在圆底烧瓶内放入少许碎瓷片,其作用是 。
(2)写出铁与高温水蒸气反应的化学方程式: 。
(3)实验时将铁粉与石棉绒混合放在硬质玻璃管Ⅰ中,其原因可能是 (填“A”“B”或“C”)。
A.石棉绒的作用是催化剂
B.石棉绒的作用是使铁粉受热均匀
C.石棉绒的作用是作铁粉的载体以及防止铁粉被吹入导管引起堵塞
(4)酒精灯a和酒精喷灯点燃的顺序是 ,原因是 。
(5) 能证明铁与水蒸气反应的现象是 。
(6) 试管中收集的气体是氢气,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
① Na2O2和H2O ② Al和NaOH溶液 ③ MnO2和浓盐酸共热 ④ 铜片和浓硫酸共热
A. 只有①② B. 只有①③ C. 只有②③ D. 只有③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关表述正确的是( )
A.离子晶体一定含金属阳离子
B.非金属元素形成的单质一定是分子晶体
C.在共价化合物分子中各原子都形成8电子结构
D.共价键能存在于共价化合物中,也能存在于离子化合物中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com