
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 稀HNO3氧化能力弱于浓HNO3 | |
| C. | 贮存铵态氮肥时要密封保存,并放在阴凉处 | |
| D. | 硝酸只能被Zn、Fe等金属还原成H2 |
 轻松课堂单元期中期末专题冲刺100分系列答案
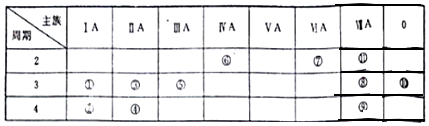
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸中加入少量铁粉:Fe+2H++NO3-═Fe3++NO↑+H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2使溶液呈中性:SO42-+Ba2++2OH-+2H+═BaSO4↓+2H2O | |
| C. | FeI2溶液中加入少量的氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 碳酸氢钠溶液加入少量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
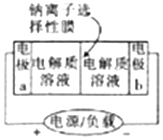 如图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列关于此电池的说法正确的是( )
如图是一种正在投入生产的大型蓄电池系统的原理图,电池中的左右两侧为电极,中间为钠离子选择性膜(电池放电和充电时该膜只允许钠离子通过),电池充、放电时反应的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列关于此电池的说法正确的是( )| A. | 电极a接触到的电解质溶液为Na2S2-Na2S4混合溶液 | |
| B. | 放电过程中.钠离子从电极b通过钠离子选择性膜移动到电极a | |
| C. | 电池放电时,负极的电极反应式为3Br--2e-=Br3- | |
| D. | 充电过程中,当有0.1molNa+通过钠离子选择性膜时.导线中通过0.2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO${\;}_{4}^{2-}$ | |
| B. | c(NaHCO3)=0.1 mol•L-1的溶液中:K+、C6H5O-、SO${\;}_{4}^{2-}$、CO32- | |
| C. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63? | |
| D. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com