
| 1 |
| 2 |
| 2.8×10-9 |
| 1×10-4 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、无色溶液中可能大量存在Cu2+、NH4+、Cl-、S2- |
| B、中性溶液中可能大量存在Fe3+、K+、Cl-、CO32- |
| C、酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| D、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与NaOH反应的氯气一定为0.25 mol |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、若反应中转移的电子为n mol,则0.30<n<0.45 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在容积为2.0L的密闭容器中,物质D在T℃时发生反应,某反应物和生成物的物质的量随时间t的变化关系如图.
在容积为2.0L的密闭容器中,物质D在T℃时发生反应,某反应物和生成物的物质的量随时间t的变化关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:
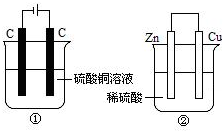 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积 ①=② |
| B、①中阴极质量增加,②中正极质量减小 |
| C、溶液的pH变化:①减小,②增大 |
| D、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.已知充电时电池总反应为:LiMn2O4═Li1-xMn2O4+xLi,下列叙述正确的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.已知充电时电池总反应为:LiMn2O4═Li1-xMn2O4+xLi,下列叙述正确的是( )| A、放电时,正极反应为xLi++xe-═xLi |
| B、放电时,a极锂的化合价不发生变化 |
| C、充电时,b极发生氧化反应 |
| D、充电时,溶液中的Li+从b极向a极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水可制取烧碱、氯气、氢气 |
| B、从海水中可提取镁、溴、碘等物质 |
| C、粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+ |
| D、在镀件上镀铜,镀件作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com